【答案】
分析:Ⅰ(1)根据铜和氧气反应生成氧化铜以及氧化铜和硫酸反应生成硫酸铜和水进行解答;
(2)根据铜和过氧化氢以及硫酸反应生成硫酸铜和水、从环保角度对两套方案的不同部分进行比较进行解答;
Ⅱ(1)根据化合物中各元素的代数和为0以及重金属盐能使蛋白质变性进行解答;
(2)根据铝和铜盐溶液反应速率与铝片是否打磨、硫酸铜溶液的浓度以及不同的铜盐有关进行解答;
Ⅲ根据硫酸铜晶体(CuSO
4?xH
2O)是蓝色的,失去结晶水后变为白色,然后设计提取的有关问题;最后考查学生的计算能力.
解答:解:Ⅰ(1)铜和氧气反应生成氧化铜,氧化铜和硫酸反应生成硫酸铜和水,化学方程式分别为2Cu+O
2 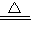
2CuO、CuO+H
2SO
4=CuSO
4+H
2O;
(2)①铜和过氧化氢以及硫酸反应生成硫酸铜和水,化学方程式为Cu+H
2O
2+H
2SO
4=CuSO
4+2H
2O;
②H
2O
2受热易分解,温度应该控制在50℃到60℃之间;
③从环保角度对两套方案的不同部分进行比较,方案一第一步灼烧会产生污染空气的气体,粉尘,烟雾,由此可知方案2更合理;
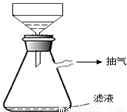
④在过滤时,采用了右图所示的装置,你认为这样做的优点是加快过滤的速度;
Ⅱ(1)由化合物中各元素的代数和为0以及氢氧根的化合价为-1价,硫酸根的化合价为-2价可知Cu
4(OH)
6SO
4,其中铜元素的化合价为+2价;该化学式可以写成盐和碱的形式:CuSO
4?3Cu(OH)
2;重金属盐能使蛋白质变性,所以杀菌机理可看作是Cu
2+使病原菌失去活性,这说明病原菌的主体是蛋白质;
(2)①铝和铜盐溶液反应速率与铝片是否打磨、硫酸铜溶液的浓度以及不同的铜盐有关;同时说明铜盐溶液中的Cl
-能加快反应速率,若实验室没有CuCl
2溶液,则可以在CuSO
4溶液中加入少许盐酸;
②该反应过程要放热;经检验,产生的气体是一种能燃烧的单质,该气体是氢气,化学式为H
2;
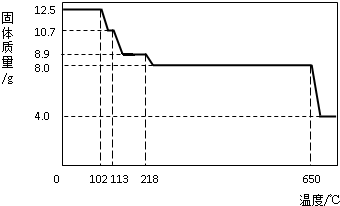
Ⅲ(1)硫酸铜晶体(CuSO
4?xH
2O)是蓝色的,失去结晶水后变为白色;
(2)硫酸铜晶体(CuSO
4?xH
2O)是蓝色的,失去结晶水后生成硫酸铜和水,化学方程式CuSO
4?xH
2O
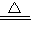
CuSO
4+xH
2O↑;
(3)650℃以上时,硫酸铜固体就会发生分解,生成黑色金属氧化物、二氧化硫及氧气,此反应的化学方程式为2CuSO
4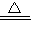
2CuO+2SO
2↑+O
2↑;
(4)由图示数据和“到650℃时该固体完全失去结晶水”可知,结晶水的质量为:12.5g-8g=4.5g
CuSO
4?xH
2O
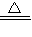
CuSO
4+xH
2O↑.
160+18x 18x
12.5g 4.5g
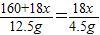
x=5
CuSO
4?5H
2O中的CuSO
4的质量分数=
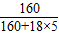
×100%=64%
答:CuSO
4?xH
2O中的CuSO
4的质量分数为64%.
故答案为:Ⅰ(1)2Cu+O
2 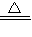
2CuO;CuO+H
2SO
4=CuSO
4+H
2O;(2)①Cu+H
2O
2+H
2SO
4=CuSO
4+2H
2O;②防止H
2O
2受热分解;③耗能少;④加快过滤的速度;
Ⅱ(1)+2价;CuSO
4?3Cu(OH)
2;蛋白质;(2)①铝片是否打磨;硫酸铜溶液的浓度;不同的铜盐;加快;盐酸;②放热;H
2;
Ⅲ(1)白;(2)CuSO
4?xH
2O
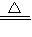
CuSO
4+xH
2O↑;(3)2CuSO
4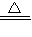
2CuO+2SO
2↑+O
2↑;(4)64%.
点评:该题为硫酸铜的知识为线索,考查了多方面的知识,难度较大.

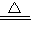 2CuO、CuO+H2SO4=CuSO4+H2O;
2CuO、CuO+H2SO4=CuSO4+H2O;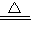 CuSO4+xH2O↑;
CuSO4+xH2O↑;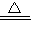 2CuO+2SO2↑+O2↑;
2CuO+2SO2↑+O2↑;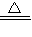 CuSO4+xH2O↑.
CuSO4+xH2O↑.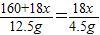
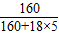 ×100%=64%
×100%=64% 2CuO;CuO+H2SO4=CuSO4+H2O;(2)①Cu+H2O2+H2SO4=CuSO4+2H2O;②防止H2O2受热分解;③耗能少;④加快过滤的速度;
2CuO;CuO+H2SO4=CuSO4+H2O;(2)①Cu+H2O2+H2SO4=CuSO4+2H2O;②防止H2O2受热分解;③耗能少;④加快过滤的速度; CuSO4+xH2O↑;(3)2CuSO4
CuSO4+xH2O↑;(3)2CuSO4 2CuO+2SO2↑+O2↑;(4)64%.
2CuO+2SO2↑+O2↑;(4)64%.

 名校课堂系列答案
名校课堂系列答案
 硫酸铜是生产、生活中常见的物质,下面是某学习小组展开的探究实录:
硫酸铜是生产、生活中常见的物质,下面是某学习小组展开的探究实录: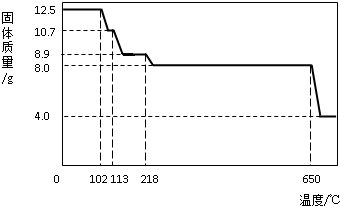
 硫酸铜是生产、生活中常见的物质,下面是某学习小组展开的探究实录:
硫酸铜是生产、生活中常见的物质,下面是某学习小组展开的探究实录: