
分析 根据质量守恒定律,在化学反应中,参加反应的各物质的质量总和等于反应后生成各物质的质量总和,可以求出生成C的质量;从而求出反应中各物质的质量比;
(1)根据反应中各物质的质量比求出参加反应的B的质量;
(2)根据化学方程式的意义解答;
(3)根据各物质的相对质量比=相对分子质量与化学计量数的积的比解答.
解答 解:根据质量守恒定律可以知道6gA和8gB恰好完全反应生成C的质量为:6g+8g-9g5g;反应中各物质的质量比为:6:8:5:9;
(1)设第二次参加反应的B的质量为x,
A+2B═2C+D
8g 5g
x 15g
$\frac{8g'}{5g}=\frac{x}{15g}$
x=24g
(2)若ABCD的相对分子质量分别为a、b、c、d,则
A+2B═2C+D
a 2b 2c d
则每a份质量的A和每2b份质量的B生成2c份质量的C和d份质量的D;反应中各物质的相对质量比为 a:2b:2c:d;
(3)若A的相对分子质量为M,设C的相对分子质量为y
A+2B═2C+D
M 2y
6g 5g
$\frac{M}{2y}=\frac{6g}{5g}$
y=$\frac{5M}{12}$
故答案为:
5; 6:8:5:9;
(1)24;
(2)a、2b、2c、d;a:2b:2c:d
(3)$\frac{5M}{12}$
点评 本题主要考查学生运用质量守恒定律进行推断的能力,需认真分析,找出质量关系,就可以求解.


 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案 应用题作业本系列答案
应用题作业本系列答案科目:初中化学 来源: 题型:选择题
| A. | ①②③ | B. | ④⑤⑥ | C. | ③④⑤ | D. | ①②⑥ |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 16 | B. | 24 | C. | 80 | D. | 40 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
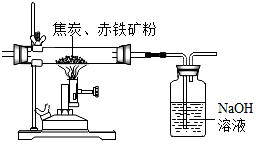 工业上,煤炭燃烧前进行粉碎的目的是使反应物充分接触,加快反应速率.煤隔绝空气加强热得到的焦炭,是冶铁的重要原料.为了测定某赤铁矿中氧化铁的质量分数,化学兴趣小组的同学设计了两种实验方案(假设该赤铁矿中的杂质既不溶于水,也不发生反应).
工业上,煤炭燃烧前进行粉碎的目的是使反应物充分接触,加快反应速率.煤隔绝空气加强热得到的焦炭,是冶铁的重要原料.为了测定某赤铁矿中氧化铁的质量分数,化学兴趣小组的同学设计了两种实验方案(假设该赤铁矿中的杂质既不溶于水,也不发生反应).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com