
 (1)在非金属单质中,活泼性强的非金属可以把活泼性弱的非金属从溶液中置换出来.例如:Cl2+2NaBr=Br2+2NaCl Br2+2NaI=I2+2NaBr I2+Na2S=S↓+2NaI Cl2+2NaI=I2+2NaCl
(1)在非金属单质中,活泼性强的非金属可以把活泼性弱的非金属从溶液中置换出来.例如:Cl2+2NaBr=Br2+2NaCl Br2+2NaI=I2+2NaBr I2+Na2S=S↓+2NaI Cl2+2NaI=I2+2NaCl Fe+2HCl;
Fe+2HCl;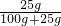 ×100%=20%
×100%=20% Fe+2HCl;(3)①Ne;②镁离子;(4)①C;②20%.
Fe+2HCl;(3)①Ne;②镁离子;(4)①C;②20%.

 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
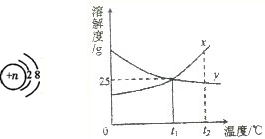 (1)在非金属单质中,活泼性强的非金属可以把活泼性弱的非金属从溶液中置换出来.例如:Cl2+2NaBr=Br2+2NaCl Br2+2NaI=I2+2NaBr I2+Na2S=S↓+2NaI Cl2+2NaI=I2+2NaCl
(1)在非金属单质中,活泼性强的非金属可以把活泼性弱的非金属从溶液中置换出来.例如:Cl2+2NaBr=Br2+2NaCl Br2+2NaI=I2+2NaBr I2+Na2S=S↓+2NaI Cl2+2NaI=I2+2NaCl
| ||
| ||
查看答案和解析>>
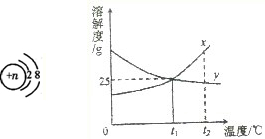
科目:初中化学 来源:不详 题型:填空题
查看答案和解析>>
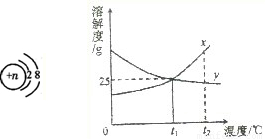
科目:初中化学 来源:2009年广东省广州市华师附中高中素质班招生考试化学试卷(解析版) 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com