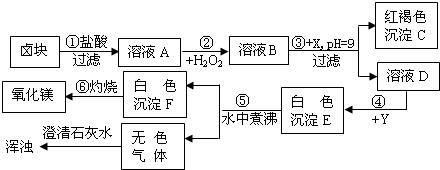
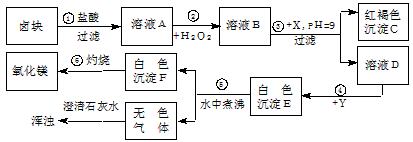
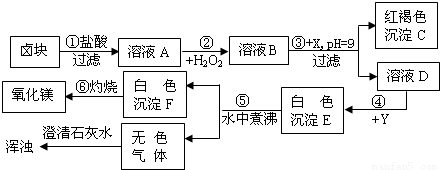
解:(1)根据氢氧化铁沉淀是红褐色的,所以C就是氢氧化铁,根据Fe
3+存在时,只有pH>9.5才会生成Mg(OH)
2沉淀,氢氧化铁沉淀是加入X后,pH=9生成的可知液B中存在铁离子,过氧化氢在酸性条件下具有很强的氧化性,可将Fe
2+氧化为Fe
3+,所以A溶液中存在亚铁离子,根据“卤块”主要成分为氯化镁,含少量FeCl
2等杂质,所以A就是氯化亚铁,B就是氯化铁,D就是氯化镁,氯化铁和X会生成氢氧化铁,所以X就是可溶性的强碱,无色的气体会使澄清石灰水变浑浊,无色的气体就是二氧化碳,白色沉淀F灼烧会生成氧化镁,依据不溶性的碱加热后会生成金属氧化物和水,所以F就是氢氧化镁,根据MgCO
3在水中煮沸可转化为更难溶的Mg(OH)
2可知E就是碳酸镁,知道了反应物氯化镁和生成物碳酸镁,Y就是可溶性的碳酸盐,故答案为:NaOH Na
2CO
3(MgCO
3在水中煮沸可转化为更难溶的Mg(OH)
22)③氯化铁和氢氧化钠反应生成氢氧化铁和氯化钠,故答案为:FeCl
3+3NaOH═Fe(OH)
3↓+3NaCl
④氯化镁和碳酸钠反应生成碳酸镁沉淀和氯化钠,故方程式为:MgCl
2+Na
2CO
3═MgCO
3↓+2NaCl
⑤MgCO
3在水中煮沸可转化为更难溶的Mg(OH)
2和水,故答案为:MgCO
3+H
2O

Mg(OH)
2↓+CO
2↑
⑥不溶性的碱受热会分解成金属氧化物和水,故答案为:Mg(OH)
2
MgO+H
2O
分析:(1)根据氢氧化铁沉淀是红褐色的,所以C就是氢氧化铁,当有Fe
3+存在时,只有pH>9.5才会生成Mg(OH)
2沉淀,氢氧化铁沉淀是加入X后,pH=9生成的,所以溶液B中存在铁离子,过氧化氢在酸性条件下具有很强的氧化性,可将Fe
2+氧化为Fe
3+,所以A溶液中存在亚铁离子,根据“卤块”主要成分为氯化镁,含少量FeCl
2等杂质,所以A就是氯化亚铁,B就是氯化铁,D就是氯化镁,氯化铁和X会生成氢氧化铁,所以X就是可溶性的强碱,氢氧化钠就行,无色的气体会使澄清石灰水变浑浊,无色的气体就是二氧化碳,白色沉淀F灼烧会生成氧化镁,依据不溶性的碱加热后会生成金属氧化物和水,所以F就是氢氧化镁,根据MgCO
3在水中煮沸可转化为更难溶的Mg(OH)
2可知E就是碳酸镁,知道了反应物氯化镁和生成物碳酸镁,Y就是可溶性的碳酸盐,碳酸钠就行,
(2)根据(1)中推出的各个反应的反应物生成物结合反应条件书写化学方程式.
点评:本题主要考查了根据题中的已知的条件进行物质的推断,本题的关键点就是:红褐色的沉淀.

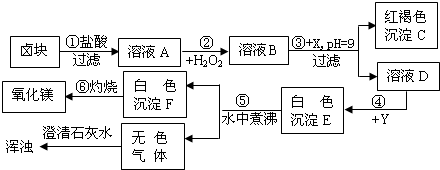
 Mg(OH)2↓+CO2↑
Mg(OH)2↓+CO2↑ MgO+H2O
MgO+H2O