
| 试剂X | 试剂Y | 试剂Z | 最终得到白色沉淀 | ||
| 甲组 | ① | CaCl2 | AgCl | ||
| 乙组 | ② | HNO3 | |||


 名校课堂系列答案
名校课堂系列答案科目:初中化学 来源: 题型:
| 物质 | 肥皂水 | 雨水 | 糖水 | 柠檬汁 | 洗洁精 |
| pH | 10.2 | 5.2 | 7.0 | 2.5 | 12.2 |
查看答案和解析>>
科目:初中化学 来源: 题型:
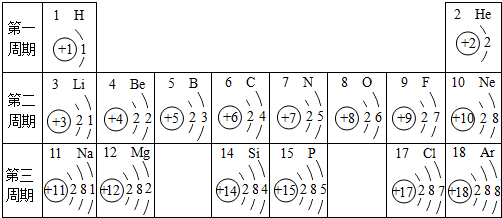
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
| A、它们的最外层电子数相同 |
| B、它们的质子数和中子数都不同 |
| C、它们的核外电子数不同 |
| D、它们的性质完全相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com