质量相同的铁、镁、锌分别与足量的稀盐酸反应,产生H2最多的是________.
镁
分析:根据金属元素的相对原子质量和它们与稀盐酸反应的化学方程式,计算出1g这些金属分别与足量稀盐酸反应生成氢气的质量,再进行比较即可.
解答:根据化学方程式:Mg+2HCl═MgCl
2+H
2↑;Zn+2HCl═ZnCl
2+H
2↑Fe+2HCl═FeCl
2+H
2↑;
可以看出:Mg的相对原子质量为24,24g镁可反应生成2g氢气,即1g镁生成
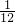
克氢气.
Zn的相对原子质量为65,65g锌可反应生成2g氢气,即1g锌生成

克氢气.
铁的相对原子质量56,56g铁可反应生成2g氢气,即1g铁生成
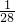
g氢气.
因为
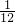
>
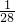
>

所以镁放出的氢气最多.
故答案为:镁;
点评:本题主要考查学生运用化学方程式综合分析和解决实际问题的能力.增加了学生分析问题的思维跨度,强调了学生整合知识的能力

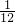 克氢气.
克氢气. 克氢气.
克氢气.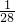 g氢气.
g氢气.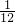 >
>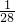 >
>

