
【题目】CaCO3在生产生活中有广泛的用途.
(1)煅烧石灰石可制得活性CaO,反应的化学方程式为 . 为测定不同煅烧温度对CaO活性的影响,取石灰石样品分为三等分,在同一设备中分别于800℃、900℃和1000℃条件下煅烧,所得固体分别与等质量的水完全反应,测得反应液温度随时间的变化如图1所示.可知:CaO与水反应会热量(填“放出”或“吸收”);上述温度中,℃煅烧所得CaO活性最高.要得出正确结论,煅烧时还需控制的条件是 .
(2)以电石渣[主要成分为Ca(OH)2 , 还含有少量MgO等杂质]为原料制备高纯CaCO3的流程如下: 
①如图为NH4Cl浓度对钙、镁浸出率的影响(浸出率= ![]() ×100%).可知:较适宜的NH4Cl溶液的质量分数为;浸取时主要反应的化学方程式为 .
×100%).可知:较适宜的NH4Cl溶液的质量分数为;浸取时主要反应的化学方程式为 .
②流程中虚线内部分若改用溶液(填化学式),可一步得到与原流程完全相同的生成物.
③流程中虚线内部若改用Na2CO3溶液,也能得到高纯CaCO3 , 试从生物的角度分析原流程的优点:
a.NH3可循环利用;b. . 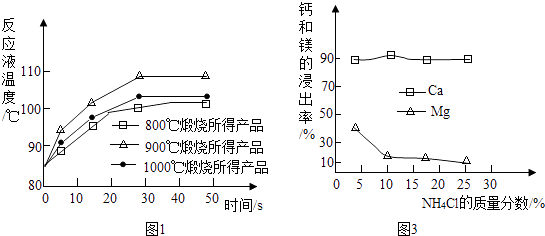
【答案】
(1)CaCO3 ![]() CaO+CO2↑;放出;900;煅烧时的时间
CaO+CO2↑;放出;900;煅烧时的时间
(2)10%;2NH4Cl+Ca(OH)2=CaCl2+2NH3↑+2H2O;NH4HCO3;NH4Cl可以循环使用
【解析】解:(1)碳酸钙在高温的条件下生成氧化钙和二氧化碳,化学方程式为:CaCO3 ![]() CaO+CO2↑,氧化钙和水反应生成氢氧化钙,放出热量,通过分析表中的数据可知,900℃时所得CaO活性最高,要得出正确结论,煅烧时还需控制的条件是煅烧时的时间;(2)①通过分析图象中氯化铵浸出钙离子的质量分数可知,较适宜的NH4Cl溶液的质量分数为10%,氯化铵和氢氧化钙反应生成氯化钙、氨气和水,所以浸取时主要反应的化学方程式为:2NH4Cl+Ca(OH)2=CaCl2+2NH3↑+2H2O;②图中的流程分析可知,碳酸氢铵和氨水、二氧化碳所起的作用是相同的,所以流程中虚线内部分若改用NH4HCO3溶液;③流程中虚线内部若改用Na2CO3溶液,也能得到高纯CaCO3 , 除了氨气可以循环使用,NH4Cl可以循环使用. 故答案为:(1)CaCO3
CaO+CO2↑,氧化钙和水反应生成氢氧化钙,放出热量,通过分析表中的数据可知,900℃时所得CaO活性最高,要得出正确结论,煅烧时还需控制的条件是煅烧时的时间;(2)①通过分析图象中氯化铵浸出钙离子的质量分数可知,较适宜的NH4Cl溶液的质量分数为10%,氯化铵和氢氧化钙反应生成氯化钙、氨气和水,所以浸取时主要反应的化学方程式为:2NH4Cl+Ca(OH)2=CaCl2+2NH3↑+2H2O;②图中的流程分析可知,碳酸氢铵和氨水、二氧化碳所起的作用是相同的,所以流程中虚线内部分若改用NH4HCO3溶液;③流程中虚线内部若改用Na2CO3溶液,也能得到高纯CaCO3 , 除了氨气可以循环使用,NH4Cl可以循环使用. 故答案为:(1)CaCO3 ![]() CaO+CO2↑,放出,900,煅烧时的时间;(2)①10%,2NH4Cl+Ca(OH)2=CaCl2+2NH3↑+2H2O;②NH4HCO3;③NH4Cl可以循环使用.
CaO+CO2↑,放出,900,煅烧时的时间;(2)①10%,2NH4Cl+Ca(OH)2=CaCl2+2NH3↑+2H2O;②NH4HCO3;③NH4Cl可以循环使用.
(1)根据碳酸钙在高温的条件下生成氧化钙和二氧化碳,氧化钙和水反应生成氢氧化钙,放出热量,依据图中的数据分析氧化钙的活性,和控制变量法的正确操作方法进行分析;(2)①根据图象中氯化铵浸出钙离子的质量分数进行分析;②根据图中的流程分析可知,碳酸氢铵和氨水、二氧化碳所起的作用是相同的进行分析;③根据反应流程中各物质的反应进行分析.


科目:初中化学 来源: 题型:
【题目】下面是元素周期表中某些元素的部分信息,请回答下列问题:
第3周期 | 11 Na | 镁 | … | 16 S | 17 Cl | 18 Ar |
第4周期 | 19 K | 20 Ca | … | |||
(1)Mg元素的核电荷数= .
(2)钠元素和硫元素处于同一周期的原因是 .
(3)钠元素和钾元素的化学性质相似的原因是 .
(4)请写出钾元素和硫元素形成的化合物的化学式 .
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】KNO3与NaCl的溶解度曲线如图所示.下列说法正确的是( ) 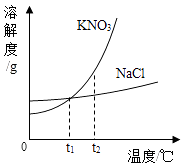
A.KNO3的溶解度大于NaCl的溶解度
B.加水能使NaCl的饱和溶液变为不饱和溶液
C.t1℃时,KNO3溶液与NaCl溶液溶质的质量分数相等
D.用冷却热饱和溶液的方法,能使KNO3从溶液中结晶析出
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】青苹果汁遇到碘水时显蓝色。在加热条件下,熟苹果汁能与新配的氢氧化铜反应,产生红色的沉淀一下列结论正确的是 ( )
A. 青苹果中含有葡萄糖 B. 熟苹果中一定不含有淀粉
C. 苹果转熟时淀粉变成葡萄糖 D. 苹果转熟时葡萄糖转变成淀粉
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图为实验室常见的气体制备、收集等装置,按要求填空. 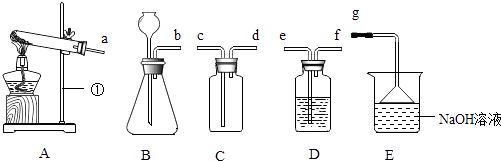
(1)写出A图中标号①仪器的名称;
(2)实验室制取二氧化碳的化学方程式为 , 用D装置验证二氧化碳能与水反应生成一种酸性物质,D中应盛放试液(填物质名称);
(3)实验室常用块状硫化亚铁固体和稀硫酸在常温下反应制取硫化氢,硫化氢(H2S)是一种有毒气体,密度比空气大,能溶于水形成氢硫酸,实验室中常用NaOH溶液来吸收有毒的硫化氢气体,若要制取并收集一瓶硫化氢气体,选择的装置中导管的连接顺序为(填写导管口标注的字母符号)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】掌握科学的研究方法,探索化学世界的奥秘.
(1)分类是学习化学的重要方法之一. ①生活中,常会接触到下列物质:
A.铜丝 B.甲烷 C.过氧化氢 D.碘酒
其中属于混合物的是(填字母,下同) , 属于氧化物的是 .
②根据物质在转化过程中的特点,可将化学反应分为化合反应,分解反应、置换反应和复分解反应四种基本反应类型,下列转化不属于这四种基本反应类型的是 .
A.生石灰与水反应 B.一氧化碳还原氧化铁 C.中和反应
(2)实验是学习化学的一条重要途径,实验室中可用KClO3在MnO2催化下受热分解制取氧气,并将反应后的混合物进行分离回收,实验操作如图所示(MnO2难溶于水) 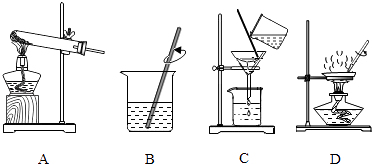
①图A中试管口略向下倾斜的原因是 , 图B操作中玻璃棒的作用是 .
②图C操作中的一处明显错误是 , 图D操作中,当看到 , 停止加热.
(3)质量守恒定律是帮助我们学习的认识化学反应实质的重要理论. ①下列表述正确的是
A.蜡烛燃烧后质量减小,说明质量守恒定律不是普遍规律
B.每32g S和32g O2完全反应后,生成64g SO2
C.在化学反应aA+bB=cC+dD中一定有:a+b=c+d
②有机化合物R与足量氧气置于密闭容器中充分反应生成CO2和H2O,实验测得反应前后物质的质量如下表:
R | O2 | CO2 | H2O | |
反应前质量/g | 46 | 128 | 0 | 0 |
反应后质量/g | 0 | 32 | x | 54 |
则x= , 已知参加反应的物质R与氧气的分子个数之比为1:3,则R的相对分子质量是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com