【答案】
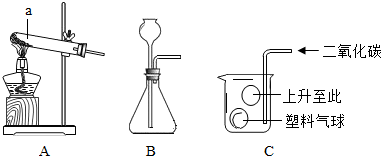
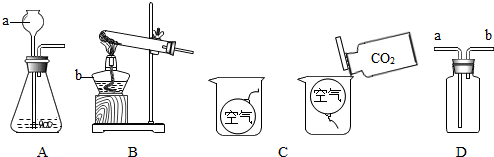
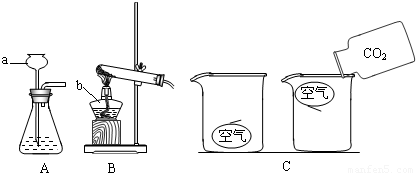
分析:(1)做实验时,常常要用到酒精灯、试管、烧杯、铁架台等化学仪器,一定要了解并识记它们;
(2)实验室用B装置制氧气,需要加热,如果选高锰酸钾制取氧气,试管口还得加一小团棉花;故只能选取氯酸钾制取氧气,所以可书写其反应的化学方程式;由题意知,黑色粉末为二氧化锰,故可书写双氧水分解的化学方程式;
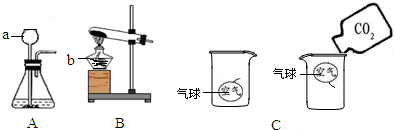
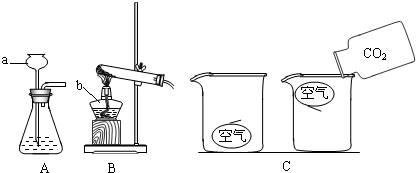
(3)制取二氧化碳不需要加热,则可选定发生装置;设计并进行有关CO
2性质的探究实验过程如图C,二氧化碳能像倒水一样倒入烧杯中,可见其密度与空气的关系;
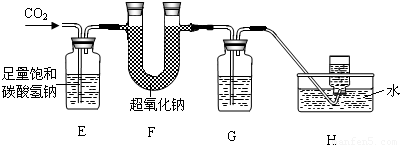
(4)①检验集气瓶内收集的气体是否为氧气,用带火星的木条,如果复燃,则证明是氧气;
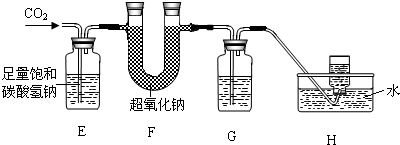
②由题意“以大理石和浓盐酸反应生成的CO
2”,因为浓盐酸易挥发,制取的二氧化碳气体中会混有氯化氢气体,故E装置的作用是用碳酸氢钠溶液除去CO
2中的HCl气体;
③由题意“采用超氧化钠(NaO
2)固体作为氧气再生剂,实现二氧化碳与氧气的转化:4NaO
2+2CO
2=2Na
2CO
3+3O
2”,则制取的氧气中可能混有多余的二氧化碳;因为二氧化碳易与氢氧化钠溶液反应,故用氢氧化钠溶液除去O
2中可能混有的CO
2;
④为了除掉水,排除干扰,则应在E、F之间添加浓硫酸,以干燥气体,除掉水分.
解答:解:(1)熟记常用仪器的名称和作用,只有很好的认识它们,做试验才能得心应手;故a为长颈漏斗,b为酒精灯;
(2)实验室用B装置制氧气,需要加热,故只能选取氯酸钾制取氧气,故可书写其反应的化学方程式2KClO
3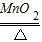
2KCl+3O
2↑;由题意知,黑色粉末为二氧化锰,故可书写双氧水分解的化学方程式2H
2O
2
2H
2O+O
2↑;
(3)制取二氧化碳不需要加热,则可选定发生装置为A;设计并进行有关CO
2性质的探究实验过程如图C,二氧化碳能像倒水一样倒入烧杯中,可探究CO
2密度和空气密度的大小关系;
(4)①检验集气瓶内收集的气体是否为氧气,用带火星的木条,如果复燃,则证明是氧气;
②由题意“以大理石和浓盐酸反应生成的CO
2”,因为浓盐酸易挥发,制取的二氧化碳气体中会混有氯化氢气体,故E装置的作用是用碳酸氢钠溶液除去CO
2中的HCl气体;
③由题意“采用超氧化钠(NaO
2)固体作为氧气再生剂,实现二氧化碳与氧气的转化:4NaO
2+2CO
2=2Na
2CO
3+3O
2”,则制取的氧气中可能混有多余的二氧化碳;因为二氧化碳易与氢氧化钠溶液反应,故用氢氧化钠溶液除去O
2中可能混有的CO
2;
④为了除掉水,排除干扰,则应在E、F之间添加浓硫酸,以干燥气体,除掉水分.
故答为:(1)长颈漏斗、酒精灯;(2)2KClO
3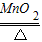
2KCl+3O
2↑;2H
2O
2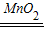
2H
2O+O
2↑;
(3)A;探究CO
2密度和空气密度的大小关系;(4)①带火星的木条;②除去CO
2中的HCl气体;③NaOH;
④在E和F装置之间增加盛有浓硫酸的洗气瓶.
点评:了解气体的除杂和干燥方法;掌握制取氧气的反应原理和检验方法;掌握二氧化碳的实验室制法及其物理性质和化学性质.

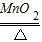 2KCl+3O2↑;由题意知,黑色粉末为二氧化锰,故可书写双氧水分解的化学方程式2H2O2
2KCl+3O2↑;由题意知,黑色粉末为二氧化锰,故可书写双氧水分解的化学方程式2H2O2 2H2O+O2↑;
2H2O+O2↑;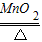 2KCl+3O2↑;2H2O2
2KCl+3O2↑;2H2O2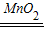 2H2O+O2↑;
2H2O+O2↑;

 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案