
 有炭粉,铁片,铜片,二氧化碳,生石灰,稀盐酸,烧碱,石灰水,纯碱,食盐10种物质,它们之间发生反应的关系如图所示.(“-”短线表示两种物质间能发生化学反应.)
有炭粉,铁片,铜片,二氧化碳,生石灰,稀盐酸,烧碱,石灰水,纯碱,食盐10种物质,它们之间发生反应的关系如图所示.(“-”短线表示两种物质间能发生化学反应.)分析 (1)因为①~⑥属于炭粉,铁片,铜片,二氧化碳,生石灰,稀盐酸,烧碱,石灰水,纯碱,食盐10种物质中的一部分,根据图,可以得到①为单质和氧化物的反应,因此单质应该是碳,氧化物为二氧化碳;反应②为单质和酸的反应,因此单质为活泼金属铁,酸味稀盐酸;反应③为二氧化碳和氢氧化钙反应产生碳酸钙沉淀和水;反应⑥为氢氧化钙和碳酸钠的反应,因此酸为稀盐酸,碱为氢氧化钙,则盐为碳酸钠Na2CO3;
(2)根据各个推断学生反应的方程式.
解答 解:(1)因为①~⑥属于炭粉,铁片,铜片,二氧化碳,生石灰,稀盐酸,烧碱,石灰水,纯碱,食盐10种物质中的一部分,根据图,可以得到①为单质和氧化物的反应,因此单质应该是碳,氧化物为二氧化碳;反应②为单质和酸的反应,因此单质为活泼金属铁,酸味稀盐酸;反应③为二氧化碳和氢氧化钙反应产生碳酸钙沉淀和水;反应⑥为氢氧化钙和碳酸钠的反应,因此酸为稀盐酸,碱为氢氧化钙,则盐为碳酸钠Na2CO3;故答案为:
(2)反应①是碳和二氧化碳反应产生一氧化碳,故反应的方程式为:C+CO2$\frac{\underline{\;高温\;}}{\;}$2CO:
反应②是铁和稀盐酸的反应产生氯化亚铁和氢气,故反应的方程式为:Fe+2HCl=FeCl2+H2↑;
反应③是二氧化碳和氢氧化钙反应产生碳酸钙沉淀和硝酸钠,故反应的方程式为:CO2+Ca(OH)2=CaCO3↑+H2O;
反应④是盐酸和氢氧化钙反应产生氯化钙和水,故反应的方程式为:2HCl+Ca(OH)2═CaCl2+2H2O.
点评 本题考查了酸碱盐,单质的转化,化学方程式的书写,属于对基础知识的考查,本题要注意化学方程式书写的规范性.


科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 凡电离时能够产生氢氧根离子的一类化合物都称为碱 | |
| B. | 燃烧都是剧烈的发热发光的化合反应 | |
| C. | 催化剂在化学反应前后,其质量和化学性质都不发生变化 | |
| D. | 白色污染的消除办法是将废弃的塑料就地焚烧 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
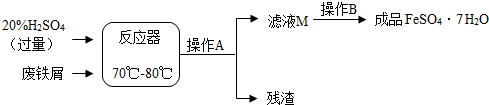
| 温度/℃ | 0 | 10 | 30 | 40 | 50 | 60 | 64 | 70 | 80 | 90 | |
| 溶解度/g | 15.6 | 20.5 | 33.0 | 40.4 | 48.8 | 55.0 | 55.3 | 50.6 | 43.7 | 37.2 | |
| 析出晶体 | FeSO4•7H2O | FeSO4•4H2O | FeSO4•H2O | ||||||||
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com