AC
分析:根据Al
2(SO
4)
3溶液与KOH溶液的反应计算分析,20mL1mol/LAl
2(SO
4)
3全转化为沉淀的质量为:0.02L×2mol/L×78g/mol=3.12g,根据Al
3++3OH
-=Al(OH)
3↓和Al(OH)
3+OH
-=AlO
2-+H
2O,可知KOH存在两种情况,一是不足,二是使Al(OH)
3部分溶解,以此计算.
解答:20mL1mol/LAl
2(SO
4)
3完全转化为沉淀的质量为0.02L×2mol/L×78g/mol=3.12g,
根据Al
3++3OH
-=Al(OH)
3↓和Al(OH)
3+OH
-=AlO
2-+H
2O,可知KOH存在两种情况,一是不足,
二是使Al(OH)
3部分溶解,
设KOH的浓度为c,当KOH不足时,
Al
3++3OH
-=Al(OH)
3↓
3mol 78g
0.03L×c 0.78g
c=

=1mol/L,
当KOH使Al(OH)
3部分溶解时,设KOH的物质的量为x,根据反应:
Al
3++3OH
-=Al(OH)
3↓
1mol 3mol 78g
0.04mol 0.12mol 3.12g
Al(OH)
3+OH
-=AlO
2-+H
2O
78g 1mol
(3.12-0.78)g (x-0.12mol)
x=0.15mol,
则KOH的物质的量浓度为:c=
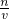
=

=5mol/L,
由上述分析计算可知,KOH溶液的物质的量浓度为1mol/L或5mol/L,所以AC正确,BD错误.
故选AC.
点评:本题考查物质的量浓度的计算,题目难度中等,注意判断氯化铝反应的程度,为解答本题的关键,用讨论法解答.

 =1mol/L,
=1mol/L,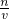 =
= =5mol/L,
=5mol/L,
