解(1)根据题目中信息“NaN
3受撞击会生成Na、N
2”可得此反应的反应物是叠氮化钠,生成物是钠和氮气,反应条件是撞击,故答案为:2NaN
3
2Na+3N
2↑;
(2)工业级NaN
3中常含有少量的Na
2CO
3,其原因是氢氧化钠和空气中的二氧化碳反应反应生成碳酸钠,故答案为:2NaOH+CO
2═Na
2CO
3+H
2O
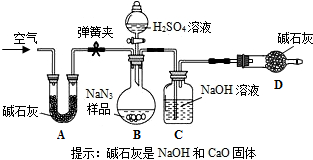
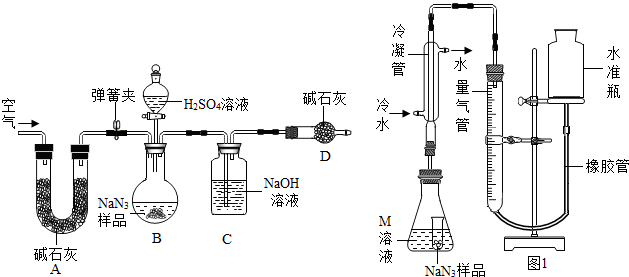
(3)①装置I用浓盐酸与样品反应,浓盐酸具有挥发性,产生的氯化氢气体被装置B吸收,二氧化碳气体逸出时带出的水蒸气在装置B中冷凝而被吸收;装置A内空气中的二氧化碳被装置B吸收;A中生成的二氧化碳不能全部进入B装置,使实验产生误差等.故答案为:浓盐酸有挥发性,挥发出的氯化氢气体会带来实验误差;
②装置II中A中药品是碱石灰,碱石灰可作干燥剂,能吸收空气中的水分和二氧化碳,防止空气中水蒸汽和二氧化碳干扰试验;C装置的浓硫酸干燥CO
2气体,若无C装置会使实验结果偏大;CO
2通入澄清石灰水,使澄清石灰水变浑浊,装置E的作用是检验二氧化碳是否被D装置完全吸收,防止空气中的二氧化碳和水蒸气进入D装置.故答案为:吸收空气中的二氧化碳和水;偏大;
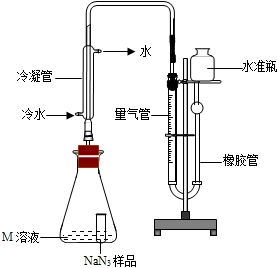
③根据装置II,小组同学设计的实验步骤为:称量样品,检查装置气密性;打开弹簧夹,鼓入空气;称量装置D;打开分液漏斗的活塞和玻璃塞,注入足量的稀硫酸,关闭活塞和玻璃塞;打开弹簧夹,鼓入空气;称量装置D;其正确顺序为 bcadca;
(4)①本实验中首先发生的反应是:2Na
2CO
3+H
2SO
4=2NaHCO
3+Na
2SO
4,然后发生的反应是:2NaHCO
3+H
2SO
4=Na
2SO
4+2H
2O+2CO
2↑.从图甲可看出当加入稀硫酸的质量是50g时开始生成二氧化碳,从而导致溶液质量增加变慢;当加入稀硫酸100g的时候,二氧化碳不再产生,溶液质量增加速率恢复到以前.故答案为:
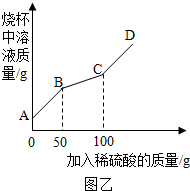
②从图甲看,最多生成的二氧化碳的质量是4.4g.设样品中碳酸钠的质量是x.
Na
2CO
3+H
2SO
4=Na
2SO
4+H
2O+CO
2↑
106 44
x 4.4g
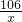
=
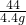
解得:x=10.6g
根据质量分数公式可得该样品中纯碱的质量分数为:
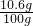
×100%=10.6%
答:该样品中纯碱的质量分数为10.6%.
分析:(1)根据信息“NaN
3受撞击会生成Na、N
2”判断反应物、生成物、反应条件,然后写出方程式;
(2)氢氧化钠和空气中的二氧化碳反应反应生成碳酸钠,据此回答;
(3)①浓盐酸易挥发,产生的氯化氢气体,进入B装置;二氧化碳气体逸出时带出的水蒸气在装置B中冷凝而被吸收;装置A内空气中的二氧化碳被装置B吸收;A中生成的二氧化碳不能全部进入B装置,使实验产生误差等.据此分析;
②根据碱石灰、浓硫酸、澄清石灰水的成分和用途回答;
③根据反应原理设计试验步骤;
(4)①从题目中给出的反应原理和图象进行分析解答;
②此反应的总的化学方程式是Na
2CO
3+H
2SO
4=Na
2SO
4+H
2O+CO
2↑,根据图中生成的二氧化碳的质量和化学方程式Na
2CO
3+H
2SO
4=Na
2SO
4+H
2O+CO
2↑计算出样品中碳酸钠的质量,然后根据质量分数公式便可计算出样品中纯碱的质量分数.
点评:综合实验涉及知识面广,对学生思维能力要求高,既考查知识的识记、理解、迁移、运用,又考查分析、对比、归纳等思维能力,符合素质教育培养学生能力的要求,对这类题目要重点训练.



 2Na+3N2↑;
2Na+3N2↑;
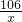 =
=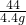
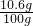 ×100%=10.6%
×100%=10.6%