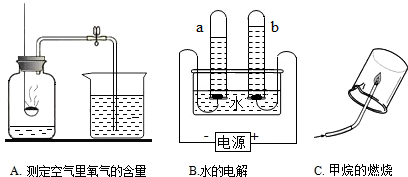
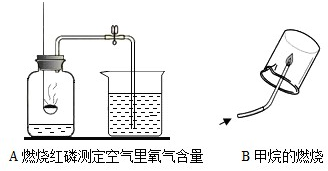
解:(1)测定空气中氧气含量的实验中,气体减少的体积小于l/5的可能原因:①红磷的量不足,瓶内氧气没有耗尽;②装置漏气(如塞子未塞紧、燃烧匙与橡皮塞之间有缝隙 等); ③未冷却至室温就打开弹簧夹,使进入瓶内的水的体积减少等;故导致A实验测定结果偏小的可能原因有:红磷少(或装置气密性不好等);
B实验通过验证反应产物二氧化碳和水并根据化学反应前后元素种类不变推测甲烷一定含有碳元素和氢元素,可能含有氧元素的结论;
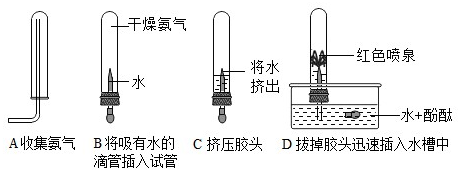
(2)根据向下排空气法收集氨气的方法可知氨气的密度比空气小;根据形成喷泉的现象说明氨气易溶于水、且喷泉是红色的,同时说明氨气的水溶液显碱性的化学性质;
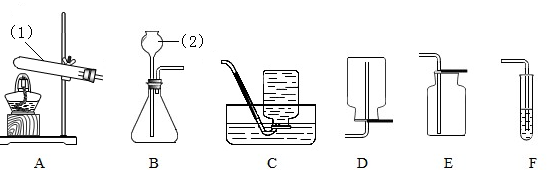
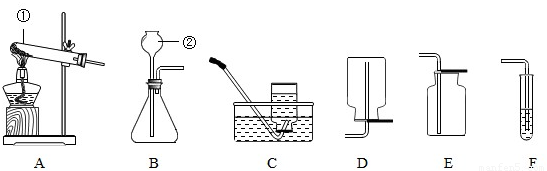
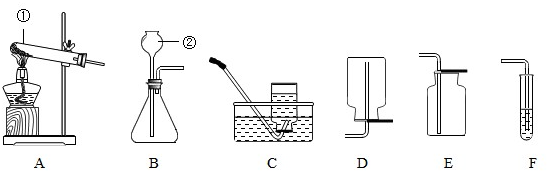
(3))(Ⅰ)①是试管; ②是长颈漏斗;
(Ⅱ)用氯酸钾制取氧气,产生氯化钾和氧气,反应方程式为:2KClO
3
2KCl+3O
2↑;
制取气体时在加药品前,需要检查装置的气密性,然后装药品和放棉花、固定试管、加热,收集氧气、将导管从水槽中取出、停止加热;
(Ⅲ)制取二氧化碳的药品是石灰石和稀盐酸,属于固体和液体在常温下的反应,因此应选用的发生装置是B;因为二氧化碳易溶于水,密度比空气大,故收集装置E(向上排空气法);反应的化学方程式为:CaCO
3+2HCl=CaCl
2+CO
2↑+H
2O;
(Ⅳ)若进行木炭还原氧化铜实验,需用A装置外,因为还要检验反应的产物,故还需连接F装置;实验结束后,先用弹簧夹将连接两个装置的橡皮管夹住,然后熄灭酒精灯,这样做除了能防止生成的铜被氧化外,因为停止加热后会使试管骤冷,因此还具有的作用是:防止F中溶液倒吸,使试管爆裂.
故答案为:(1)①红磷少(或装置气密性不好等); ②元素
(2)密度比空气小 易溶于水
(3)(Ⅰ)①试管 ②长颈漏斗;(Ⅱ) 2KClO
3
2KCl+3O
2↑ 气密性检查
(Ⅲ) B E CaCO
3+2HCl=CaCl
2+CO
2↑+H
2O
(Ⅳ) F 检验气体生成物 防止F中溶液倒吸,使试管爆裂
分析:(1)测定空气中氧气含量的实验中,气体减少的体积小于l/5的可能原因:①红磷的量不足,瓶内氧气没有耗尽;②装置漏气(如塞子未塞紧、燃烧匙与橡皮塞之间有缝隙 等); ③未冷却至室温就打开弹簧夹,使进入瓶内的水的体积减少等;根据甲烷燃烧的产物是二氧化碳和水,推测甲烷的元素组成;
(2)根据实验的现象推测氨气的性质;
(3)(Ⅰ) 熟练掌握常见化学仪器的名称及其用途;(Ⅱ)用氯酸钾制取氧气,产生氯化钾和氧气,写出方程式;根据实验的步骤回答操作;
(Ⅲ)根据反应物的状态和反应条件选择发生装置;根据气体的密度和溶解性选择收集方法;
(Ⅳ)根据木炭还原氧化铜实验的装置特点分析.
点评:本题考查了测定空气中氧气的体积分数的有关问题、常见气体的制取和收集等,知识面较广,关键是了解用红磷测定氧气在空气中含量的实验的注意事项、了解实验数据的处理或者误差分析的方法及技巧及常见气体的制取装置、收集方法等的选择等.

 2KCl+3O2↑;
2KCl+3O2↑; 2KCl+3O2↑ 气密性检查
2KCl+3O2↑ 气密性检查