化学语言
(1)常温下浓硫酸可用铁桶盛装.但盛过浓硫酸的铁桶用水清洗时要远离火源,用化学反应方程式表示其原因________;________;
(2)绿色植物在太阳光下发生光合作用:________.
(3)请在下列空格中用适当的化学式填空,除去括号中的少量杂质:
CO2(CO)________;NaNO3(NaCl)________;ZnSO4(CuSO4)________.
解:(1)盛装浓硫酸的铁桶在用水清洗时,浓硫酸被水稀释成稀硫酸,稀硫酸能与铁反应生成硫酸亚铁和氢气.
该反应的化学方程式为:Fe+H
2SO
4=FeSO
4+H
2↑.
生成的氢气与空气中的氧气在点燃条件下反应也可能发生爆炸,同时生成水.
该反应的化学方程式为:2H
2+O
2
2H
2O.
因此应远离火源.
(2)二氧化碳和水在光的作用下反应生成葡萄糖和氧气.
该反应的化学方程式为:6CO
2+6H
2O
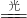
C
6H
12O
6+6O
2.
(3)由于一氧化碳具有还原性,能与氧化铜在加热条件下反应生成铜和二氧化碳.利用一氧化碳的这一性质,可以选氧化铜将二氧化碳中的一氧化碳杂质转化为二氧化碳.氧化铜的化学式为CuO.
由于氯化钠能与硝酸银反应生成氯化银沉淀和硝酸钠.利用氯化钠的这一性质,可以选硝酸银溶液将硝酸钠中的氯化钠杂质转化为硝酸钠.硝酸银的化学式为AgNO
3.
由于锌能与硫酸铜反应生成铜和硫酸锌.因此利用锌的这一性质能将硫酸锌中的硫酸铜转化为硫酸锌.锌的化学式为Zn.
故答案为:
(1)Fe+H
2SO
4=FeSO
4+H
2↑;2H
2+O
2
2H
2O
(2)6CO
2+6H
2O
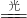
C
6H
12O
6+6O
2(3)CuO;AgNO
3;Zn
分析:只有熟悉质量守恒定律的两个原则、化学方程式的书写方法、常见物质的性质和用途、光合作用和物质除杂质的原理,才能得出本题的正确答案.
点评:本题主要考查质量守恒定律的应用、物质的性质和用途、光合作用和物质除杂质的原理,难度较大.

 2H2O.
2H2O.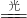 C6H12O6+6O2.
C6H12O6+6O2. 2H2O
2H2O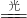 C6H12O6+6O2
C6H12O6+6O2
