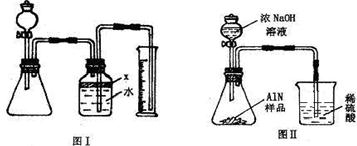
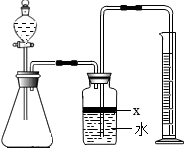
解:(1)制取气体时首先要检查装置气密性,再装药品,先装固体,再装液体,最后用排水法测氨气的体积;
(2)关闭分液漏斗开关,使装置处于密闭体系,将导管一端浸入水中,用手紧握锥形瓶外壁,由于热胀冷缩,锥形瓶内气体受热膨胀,如果导管口有气泡冒出,说明气密性良好,否则装置漏气;
(3)广口瓶中的试剂X的作用是将氨气与水隔开,因为氨气极易溶于水,由于酒精能以任意比例与水互溶,所以不能用酒精,要用植物油将氨气与水隔开,水不溶于油;
(4)反应前广口瓶的上方留有的少量空间填充的是空气,反应后广口瓶的上方留有的少量空间填充的是氨气,氨气代替了开始的空气,把最后空间中冲入的氨气当成开始时的空气即可,所以对实验结果没有影响;
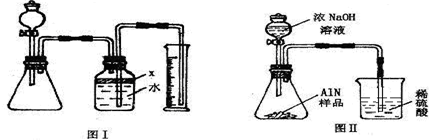
(5)氮化铝中含有碳或氧化铝杂质,氧化铝易溶于NaOH溶液,而实验结束后,若观察到锥形瓶中还有固体,说明固体不溶于氢氧化钠溶液,所以杂质是碳;
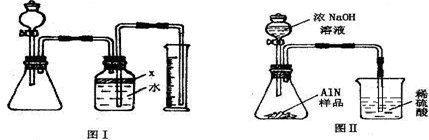
(6)根据每22.4L氨气质量为17g,计算出氨气的体积为aL的质量:
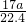
,设生成这些氨气,需要参加反应的氮化铝质量为X则:
AlN+NaOH+H
2O=NaAlO
2+NH
3↑
41 17
X
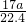
根据:
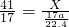
解得X=
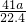
,所以样品中AlN的质量分数为:
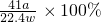
=
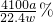
;
(7)氨气极易溶于硫酸,会使导管内压强迅速减小,使液体倒吸入导管内进入锥形瓶,在导管末端接一倒置的漏斗,不会引起液体倒吸.
故答案为:(1)cabd;(2)关闭分液漏斗开关,将导管一端浸入水中,用手紧握锥形瓶外壁,如果导管口有气泡冒出,说明气密性良好,否则装置漏气;(3)B;(4)不变;(5)碳;(6)
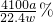
;(7)不可行;会使液体沿着导管倒吸入锥形瓶内;在导管末端接一倒置的漏斗.
分析:(1)根据制取气体的一般实验步骤考虑;(2)只要先将装置密封再利用热胀冷缩原理进行气密性验证;(3)根据广口瓶中的试剂X的作用考虑;(4)根据反应前后广口瓶的上方留有的少量空间填充气体变化考虑;(5)根据杂质是否与氢氧化钠溶液反应考虑;(6)先根据每22.4L氨气质量为17g,计算出氨气的体积为aL的质量,再根据方程式计算出AlN的质量,再除以wg乘以百分之百;(7)根据氨气极易溶于硫酸,会使导管内压强减小,使液体倒吸考虑,只要改进后能防止液体倒吸即可.
点评:解答本题要知道制取气体的一般步骤,知道用排水法测定气体体积的方法,由于氨气极易溶于水,要用植物油将氨气与水分开;知道代入方程式计算的数值只能是质量,必须把体积换算成质量再进行列比例式计算.

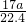 ,设生成这些氨气,需要参加反应的氮化铝质量为X则:
,设生成这些氨气,需要参加反应的氮化铝质量为X则: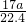 根据:
根据: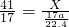 解得X=
解得X=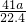 ,所以样品中AlN的质量分数为:
,所以样品中AlN的质量分数为: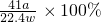 =
=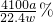 ;
;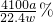 ;(7)不可行;会使液体沿着导管倒吸入锥形瓶内;在导管末端接一倒置的漏斗.
;(7)不可行;会使液体沿着导管倒吸入锥形瓶内;在导管末端接一倒置的漏斗.

 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案
 氮化铝(AlN)是一种新型无机材料,广泛应用于集成电路生产领域.某氮化铝中含有碳或氧化铝杂质,某化学研究性学习小组设计并完成了如下实验.
氮化铝(AlN)是一种新型无机材料,广泛应用于集成电路生产领域.某氮化铝中含有碳或氧化铝杂质,某化学研究性学习小组设计并完成了如下实验.