
【题目】某科研小组设计利用稀H2SO4浸取某废弃的氧化铜锌矿(主要成分为CuO和ZnO,其余成分既不与酸反应,也不溶解于水)的方案,实现废物综合利用。部分实验流程如下:
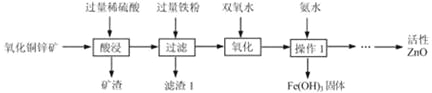
请根据上述实验流程回答下列问题:
(1)操作1的名称是 。
(2)在氧化铜锌矿中加入过量稀硫酸,主要成分发生反应的化学方程式为 , 。
(3)加过量铁粉后,发生反应的基本反应类型是 ,得到滤渣1的成分为 (填化学式)。
(4)在实验过程中,双氧水会与Fe2+反应生成Fe3+和水,以便在后续的操作中将溶液中铁元素除去。高锰酸钾溶液也能将Fe2+氧化成Fe3+,选用双氧水的优点是 。
【答案】
(1)过滤
(2)ZnO+H2SO4═ZnSO4+H2O CuO+H2SO4=CuSO4+H2O
(3)置换反应 Fe、Cu
(4)不引入较难除去的杂质
【解析】
试题分析:
(1)操作1是将液体和固体分离的操作,是过滤,故填:过滤;
(2)氧化铜锌矿的主要成份是氧化铜和氧化锌,金属氧化物与酸反应生成盐和水,其反应的化学方程式为:ZnO+H2S04═ZnS04+H20,CuO+H2SO4=CuSO4+H2O;故填:ZnO+H2S04═ZnS04+H20,CuO +H2SO4=CuSO4+H2O;
(3)加过量铁粉后,发生的反应是铁和硫酸铜的反应,生成铜和硫酸亚铁,符合置换反应的特征,由于铁粉过量,所以滤渣1的成份是铁和铜,故填:置换反应;Fe、Cu;
(4)除杂实验过程中,要注意不要引入新的杂质,特别是难除去的杂质,双氧水只含有氢和氧两种元素,会与Fe2+反应生成Fe3+和水,而不引入难除掉的其它杂质,故填:不引入较难除去的杂质。


科目:初中化学 来源: 题型:
【题目】以下对空气的说法中,不正确的是
A.空气是一种宝贵的资源 B.空气的成分一般是比较固定的
C.洁净的空气是纯净物 D.空气主要是由几种气体组成的混合物
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】用数字或化学符号填空:
(1)2个镁离子___________________
(2)保持氢气化学性质的最小粒子是________________
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】根据“粗盐中难溶性杂质的去除”实验,回答有关问题。
(1)实验步骤:
①溶解 称取5.0g粗盐,逐渐加入10mL水中,直到不再溶解,剩余粗盐1.2g。
②过滤
③蒸发 请从溶解度的角度分析,试验中不采用降低溶液温度的方法得到精盐的依据是__________________。
④计算产率 得到精盐3.2g,则精盐的产率为______(计算结果保留一位小数)。
(2)整个实验中至少要进行_____次称量。
(3)从海水中获得的粗盐,经过上述实验得到的精盐属于_______(填“混合物”或“纯净物”)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】为测定某市售碳酸钙药品中碳酸钙的质量分数(杂质为SiO2,与稀盐酸不反应),某同学的方法是:将样品与稀盐酸反应,测定反应后生成的CO2质量,再根据CO2的质量求出样品中碳酸钙的质量,从而计算出样品中碳酸钙的质量分数。为测定生成CO2的质量,他设计了如下实验方案(已知:无水氯化钙是常见的干燥剂):
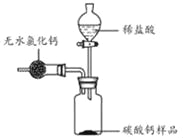
(1)按图组装好装置,检查装置气密性后,在分液漏斗中加入过量稀盐酸,并在干燥管中加入适量无水氯化钙样品,称得装置和药品的总质量为564.57g;
(2)在广口瓶中加入碳酸钙样品,称得装置和药品的总质量为574.57g;
(3)旋紧橡皮塞,打开分液漏斗旋塞,向广口瓶中滴加稀盐酸,使样品与稀盐酸完全反应;
(4)反应结束后,称得装置及装置内所有物质的总质量为570.57g。
请根据上述实验回答下列问题:
(1)该方案测得样品中碳酸钙的质量分数是多少(写出解题过程,计算结果精确到0.1%)?
(2)该实验中用稀盐酸与碳酸钙样品反应,而不用浓盐酸与碳酸钙样品反应,其原因是
。若实验中不用无水氯化钙干燥,则测得样品中碳酸钙的质量分数与上述实验计算结果相比 (选填“偏小”或“不变”或“偏大”)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】已知一个碳12原子的质量是1.993×10-26Kg,一个原子的质量为9.296×10-26Kg,又知X原子中的质子数比中子数少4,计算下列问题,
(1)X原子的相对原子质量质量; (结果保留整数)
(2)X原子的质子数 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com