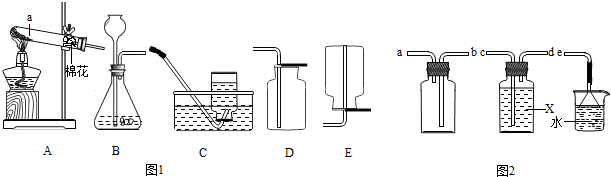
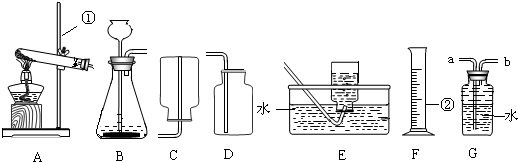
解:(1)实验室可使用过氧化氢常温下分解制取氧气,也可使用加热高锰酸钾分解的方法制取氧气,因此发生装置既可选A也可以选择装置B;其对应的反应分别为高锰酸钾受或氯酸钾热分解、过氧化氢在二氧化锰催化下常温分解;
故选A(或B);2KMnO
4
K
2MnO
4+MnO
2+O
2↑(或2KClO
3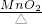
2KCl+3O
2↑),若装置选B:2H
2O
2
2H
2O+O
2↑;
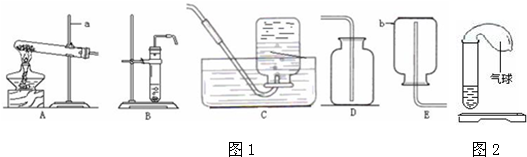
(2)使氧气从装置G的b通入而由b管排出水,排出的水使用仪器F量筒进行测量,就可得到所收集气体的体积;
故答案为:G和F;
(3)撤走装置A中的酒精灯,并把试管管口向上竖起,装置即可变换为适用于固液不需加热型发生装置而用来制取二氧化碳气体;
故答案为:移走酒精灯,试管口朝上;
(4)硫化氢气体密度比空气大且能溶于水,因此收集该气体宜采取装置D的向上排空气法收集;为防止有毒的硫化氢气体排放到空气中,根据硫化氢呈酸性的特点可选取氢氧化钠溶液进行吸收,两物质发生复分解反应,生成硫化钠和水;
故选D;H
2S+2NaOH=Na
2S+2H
2O(与其它碱溶液反应,化学方程式正确也可)
分析:(1)根据实验室采取不同反应原理制取氧气,选择适当的发生装置,并根据所选择的发生装置默写相应的化学方程式;
(2)根据装置的作用,选取可以用来测定气体体积的装置组合完成收集气体体积的测定;
(3)对装置进行适应改动,使固体加热型发生装置适用于固液不需加热型反应的发生装置;
(4)根据硫化氢性质及制取反应,确定该气体的收集装置并完成吸收多余气体的反应化学方程式的书写.
点评:制取气体的发生装置要根据制取的反应条件及药品的状态进行选择,而收集装置要根据所收集气体的密度及溶解性进行选择.

 K2MnO4+MnO2+O2↑(或2KClO3
K2MnO4+MnO2+O2↑(或2KClO3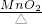 2KCl+3O2↑),若装置选B:2H2O2
2KCl+3O2↑),若装置选B:2H2O2 2H2O+O2↑;
2H2O+O2↑;

 孟建平错题本系列答案
孟建平错题本系列答案 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案