
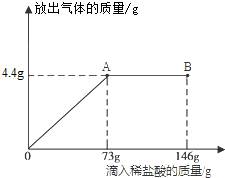
| 106 |
| x |
| 73 |
| 73g×10% |
| 73 |
| 73g×10% |
| 44 |
| y |
| 73 |
| 73g×10% |
| 117 |
| z |


 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案科目:初中化学 来源: 题型:
| A、硫在氧气中燃烧发出蓝紫色火焰 |
| B、铁丝在氧气中燃烧火星四射 |
| C、红磷燃烧产生大量白雾 |
| D、镁带在空气中燃烧发出耀眼白光 |
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
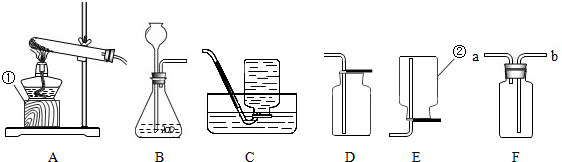
查看答案和解析>>
科目:初中化学 来源: 题型:
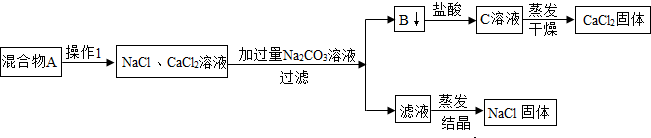
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com