
 =
=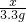 ,
, =7.5g,
=7.5g,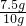 ×100%=75%.
×100%=75%.

科目:初中化学 来源: 题型:
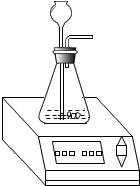 某化学兴趣小组为测定实验室中一瓶久置的过氧化氢溶液中溶质的质量分数,进行如下实验.
某化学兴趣小组为测定实验室中一瓶久置的过氧化氢溶液中溶质的质量分数,进行如下实验.查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
| 时间/s | 0 | 20 | 40 | 60 | 80 | 100 | 120 |
| 石灰水增加的质量/g | 0 | 3.0 | 5.0 | 6.0 | 6.6 | 6.6 | 6.6 |
查看答案和解析>>
科目:初中化学 来源: 题型:
 (2012?乐山二模)某化学兴趣小组为测定一种石灰石样品中碳酸钙的质量分数,进行如下实验:①称取25.0g石灰开佯品,平均分成两份,并分别加工成块状和粉末状; ②将两份样品分别投入两个锥形瓶中,各加入足量的相同溶质质量分数的稀盐酸(样品所含杂质不溶于水也不与酸反应),测得生成二氧化碳的质量与反应时间的关系如图所示:
(2012?乐山二模)某化学兴趣小组为测定一种石灰石样品中碳酸钙的质量分数,进行如下实验:①称取25.0g石灰开佯品,平均分成两份,并分别加工成块状和粉末状; ②将两份样品分别投入两个锥形瓶中,各加入足量的相同溶质质量分数的稀盐酸(样品所含杂质不溶于水也不与酸反应),测得生成二氧化碳的质量与反应时间的关系如图所示:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com