
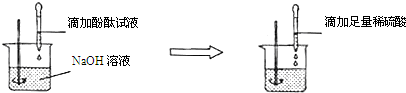
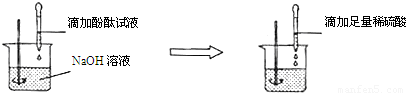
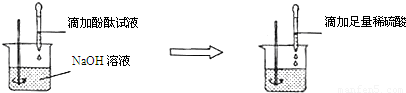
向盛有NaOH溶液的烧杯中滴入几滴酚酞试液,试液变为____________色,此时溶液的pH______________,向此溶液中逐渐滴加稀盐酸,并不断振荡,直至试液刚好无色时,溶液呈______________性,pH______________;继续滴入稀HCl,溶液呈______________色,pH______________,在整个实验过程中,溶液发生了______________反应,化学方程式为_____________________。
红 >7 中 =7 无 <7 中和 NaOH+HCl===NaCl+H2O
【解析】考点定位分析:本题的考点是中和反应及其应用,酸碱指示剂及其性质,溶液的酸碱性与pH值的关系,书写化学方程式。中和反应是指酸与碱作用生成盐和水的反应,其实质是酸溶液中的H+和碱溶液中的OH-结合生成水。酸碱指示剂是指能够与酸性或碱性的溶液起作用而显示不同颜色的物质。它们的主要性质是紫色的石蕊试液遇酸性溶液变成红色,遇碱性溶液变成蓝色;无色的酚酞试液遇酸性溶液不变色,遇碱性溶液变成红色。溶液酸碱性强弱的酸碱度则需要使用pH试纸进行测量,pH<7时,溶液呈酸性,pH>7时,溶液呈碱性,pH=7时,溶液呈中性。
解答过程分析:根据酸碱的基本性质和中和反应进行分析。氢氧化钠是一种常见的碱,其溶液呈碱性,能使无色酚酞变成红色,其溶液的酸碱度大于7;氢氧化钠能与盐酸发生中和反应,生成氯化钠和水,氯化钠溶液呈中性,因此在与盐酸恰好完全反应时,所得溶液呈中性,溶液的酸碱度等于7;继续滴加稀盐酸,由于盐酸的过量而使溶液酸性增强,溶液的酸碱度小于7,酚酞仍为无色。
试题总结评价:本题以氢氧化钠为例考查了碱类物质的性质,碱溶液能使酚酞变成红色,能与酸进行中和而使溶液呈中性。


 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源:同步题 题型:填空题
查看答案和解析>>
科目:初中化学 来源:2010-2011学年江西省赣州市石城二中九年级(下)最后一次月考化学试卷(解析版) 题型:解答题
查看答案和解析>>
科目:初中化学 来源:2011年江苏省泰州市靖江市中考化学模拟试卷(解析版) 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com