
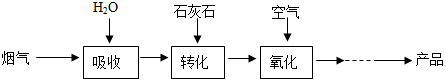
分析 (1)根据将烟气中的SO2直接排放到空气中,可能会导致酸雨,根据二氧化硫能使高锰酸钾溶液褪色进行分析;
(2)根据碳酸钙和亚硫酸反应会生成亚硫酸钙、水和二氧化碳进行分析;
(3)根据亚硫酸钙和氧气反应生成硫酸钙,反应前后各元素的化合价进行分析;
(4)根据硫酸钙分解的反应原理分析解答;
(5)二氧化硫与碳酸钙反应生成亚硫酸钙与二氧化碳,亚硫酸钙在水存在的条件下被氧气氧化生成CaSO4•2H2O;根据关系式S~SO2~CaSO4•2H2O来计算;
(6)根据不利于脱硫的影响因素进行分析;
解答 解:
(1)将烟气中的SO2直接排放到空气中,可能会导致酸雨;可用使高锰酸钾溶液检验烟气中二氧化硫;
(2)碳酸钙和亚硫酸反应会生成亚硫酸钙、水和二氧化碳,所以设备2中,加入CaCO3的目的是将H2SO3转化为CaSO3;反应的化学方程式是:CaCO3+H2SO3═CaSO3+SO2↑+H2O; 基本类型是复分解反应;
(3)亚硫酸钙和氧气反应生成硫酸钙,化学方程式为:2CaSO3+O2+4H2O=2(CaSO4•2H2O)或2CaSO3+O2=2CaSO4;
(4)硫酸钙在高温条件下会分解生成二氧化硫和另外2种生成物,其中一种是金属氧化物.硫酸钙分解的化学方程式是:2CaSO4$\frac{\underline{\;\;△\;\;}}{\;}$2CaO+2SO2↑+O2↑;
(5)二氧化硫与碳酸钙反应生成亚硫酸钙与二氧化碳,反应方程式为:SO2+CaCO3=CaSO3+CO2,亚硫酸钙在水存在的条件下被氧气氧化生成CaSO4•2H2O,反应方程式为:2CaSO3+O2+4H2O=2(CaSO4•2H2O),总反应为:2CaCO3+2SO2+O2+4H2O═2(CaSO4•2H2O)+2CO2;
故答案为:SO2+CaCO3=CaSO3+CO2;2CaSO3+O2+4H2O=2(CaSO4•2H2O);
S~SO2 ~CaSO4•2H2O
32 172
200t×2.5%×96% m
$\frac{32}{200t×2.5%×96%}=\frac{172}{m}$
m=25.8t
(6)在整个转化过程中,不利于脱硫的影响因素是烟尘含量过高和烟气温度过高;
答案:
(1)形成酸雨; 高锰酸钾;
(2)使亚硫酸完全转化为亚硫酸钙; CaCO3+H2SO3═CaSO3+SO2↑+H2O; 复分解反应;
(3)2CaSO3+O2+4H2O=2(CaSO4•2H2O)或2CaSO3+O2=2CaSO4
(4)2CaSO4$\frac{\underline{\;\;△\;\;}}{\;}$2CaO+2SO2↑+O2↑;
(5)25.8;
(6)bc
点评 本题考查了燃料脱硫的原理等,题中难度中等,注意化学方程式的书写,为该题的易错点和难点.注意流程分析和设计方法和理解是解答的关键.


科目:初中化学 来源: 题型:填空题
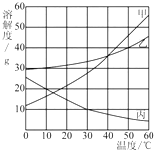 甲、乙、丙三种物质的溶解度曲线如图所示,根据图中信息回答下列问题:
甲、乙、丙三种物质的溶解度曲线如图所示,根据图中信息回答下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | CaCO3$\frac{\underline{\;高温\;}}{\;}$ CaO+CO2↑ | B. | 2H2+O2 $\frac{\underline{\;点燃\;}}{\;}$2H2O | ||
| C. | Fe+CuSO4═Cu+FeSO4 | D. | Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$ 2Fe+3CO2 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 金属钠保存在炼油中以隔绝空气和水 | |
| B. | 钠与水反应放热,使钠熔化,钠是熔点较低的金属 | |
| C. | 钠和水反应的化学方程式为 2Na+2H2O═2NaOH+H2↑ | |
| D. | 把钠投入硫酸铜溶液中会产生红色物质,溶液褪为无色 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | K2MnO4、KMnO4、MnO2三者中Mn元素的化合价逐渐升高 | |
| B. | HCl、NaCl、Na2CO3溶液的pH逐渐变大 | |
| C. | NH4NO3、NaCl、CaO三者溶于水后,所得溶液的温度逐渐降低 | |
| D. | 将Zn、Fe两金属片分别放入CuSO4溶液中可以证明三种金属的活动性顺序为Zn>Fe>Cu |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com