
| 选项 | 实验目的 | 实验操作 |
| A | 比较 Fe、Cu、Ag的金属活动性 | 将铜丝分别浸入 FeSO4溶液、AgNO3溶液中 |
| B | 验证 Na2CO3溶液中是否混有NaOH | 取少量溶液,滴加无色酚酞溶液 |
| C | 除去铁制品上的铁锈 | 将铁制品长时间浸泡在足量的稀盐酸中 |
| D | 除去二氧化碳中的氯化氢气体 | 将气体通入NaOH溶液中 |
| A. | A | B. | B | C. | C | D. | D |
分析 A、在金属活动性顺序中,位于前面的金属能把排在它后面的金属从其盐溶液中置换出来,据此判断能否发生反应,进而可确定三种金属活动性由强到弱的顺序.
B、根据碳酸钠溶液、氢氧化钠溶液均显碱性,进行分析判断.
C、根据铁、铁锈的主要成分氧化铁均能与稀盐酸反应,进行分析判断.
D、除杂质题至少要满足两个条件:①加入的试剂只能与杂质反应,不能与原物质反应;②反应后不能引入新的杂质.
解答 解:A、将铜丝分别浸入FeSO4溶液、AgNO3溶液中,铜丝不能与FeSO4溶液反应,说明金属活动性铁>铜;能与AgNO3溶液反应,说明铜>银;则Fe、Cu、Ag的金属活动性由强到弱的顺序是Fe、Cu、Ag,故选项实验操作能达到实验目的.
B、碳酸钠溶液、氢氧化钠溶液均显碱性,滴加无色酚酞溶液均显红色,不能确定Na2CO3溶液中是否混有NaOH,故选项实验操作不能达到实验目的.
C、铁、铁锈的主要成分氧化铁均能与稀盐酸反应,不能将铁制品长时间浸泡在足量的稀盐酸中,故选项实验操作不能达到实验目的.
D、CO2和HCl气体均能与NaOH溶液反应,不但能把杂质除去,也会把原物质除去,不符合除杂原则,故选项实验操作不能达到实验目的.
故选:A.
点评 本题难度不是很大,化学实验方案的设计是考查学生能力的主要类型,同时也是实验教与学难点,在具体设计时要对其原理透彻理解,可根据物质的物理性质和化学性质结合实验目的进行分析判断.


科目:初中化学 来源: 题型:多选题
| 选项 | 物质 | 杂质 | 除杂质的方法 |
| A | CO2 | 水蒸气 | 通入浓硫酸中 |
| B | KCl溶液 | K2CO3 | 加适量稀盐酸 |
| C | CaO | CaCO3 | 加水、过滤 |
| D | NaCl溶液 | Na2CO3 | 加适量硝酸钙溶液,过滤 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | NO3- Fe3+ Na+ OH- | B. | K+ SO42- Na+ NO3- | ||
| C. | C1- K+ SO42- Ba2+ | D. | Ca2+ Cl- CO32- Na+ |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 煤的干馏、酒精挥发 | B. | 干冰升华、钢铁生锈 | ||
| C. | 空气液化、气球爆炸 | D. | 高粱酿酒、牛奶变酸 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:多选题
| A | B | C | D |
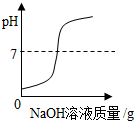 |  | 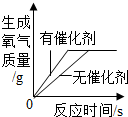 |  |
| 向一定量稀盐酸中加入过量氢氧化钠溶液 | 向一定量硫酸和硫酸铜混合溶液中加入过量的氢氧化钠溶液 | 用等质量、等溶质质量分数的双氧水分别制取氧气 | 向饱和澄清石灰水中加入固体CaO (恢复至原温度) |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 市售的碳酸氢钠片是一种白色片状药剂,主要成份为碳酸氢钠(NaHCO3),用于缓解胃酸过多引起的胃痛、胃灼热感(烧心)、反酸等有关症状,根据题意,试回答以下问题:
市售的碳酸氢钠片是一种白色片状药剂,主要成份为碳酸氢钠(NaHCO3),用于缓解胃酸过多引起的胃痛、胃灼热感(烧心)、反酸等有关症状,根据题意,试回答以下问题:查看答案和解析>>
科目:初中化学 来源: 题型:解答题
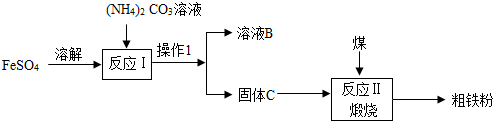

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com