
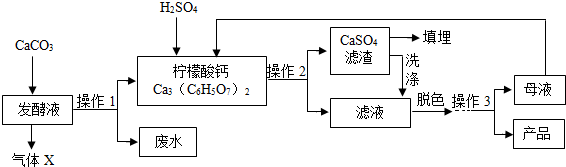
| 温度/℃ | 0 | 10 | 20 | 30 | 40 | … |
| 溶解度/g | 96 | 118 | 146 | 183 | 216 | … |
分析 (1)根据碳酸盐和酸反应会生成二氧化碳,在实验室检验二氧化碳用澄清石灰水进行分析;
(2)根据一水柠檬酸晶体的溶解性随着温度的升高而增大,所以升高温度是为了使反应更充分进行;
(3)根据复分解反应的原理进行分析;
(4)根据过滤操作可以将固体和液体分离进行分析;
(5)根据柠檬酸的溶解度进行分析;
(6)根据活性炭有吸附性进行分析;
(7)根据既可以做反应物,也是生成物的可以进行循环利用进行分析.
解答 解:(1)碳酸钙和发酵液反应得到了柠檬酸钙和废液,依据质量守恒定律,所以发酵液中含有柠檬酸,柠檬酸显酸性,柠檬酸和碳酸钙反应会生成二氧化碳气体,所以气体X是:CO2,在实验室检验二氧化碳常用澄清石灰水,氢氧化钙和二氧化碳反应生成白色的碳酸钙沉淀和水,化学方程式为:CO2+Ca(OH)2=CaCO3↓+H2O;
(2)在发酵液中加入CaCO3,同时升温至90℃,这样做的目的是:使反应更充分进行;
(3)硫酸与柠檬酸钙反应生成硫酸钙沉淀和柠檬酸,其反应方程式为:3H2SO4+Ca3(C6H5O7)2═3CaSO4↓+2C6H8O7,该反应是两种化合物相互交换成分生成两种新化合物,且有沉淀生成,属于复分解反应;
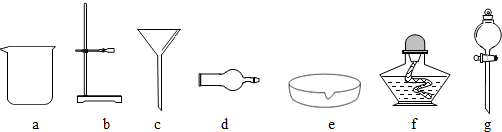
(4)经过操作1后得到了柠檬酸钙和废液,经过操作2后得到了滤渣硫酸钙和滤液,所以操作1、2的名称是:过滤;过滤使用的玻璃仪器有:漏斗、烧杯以及玻璃棒;
(5)通过柠檬酸的溶解度表可以看出,柠檬酸的溶解度受温度影响变化较大,所以要从柠檬酸的溶液中得到柠檬酸,需要先将柠檬酸蒸发浓缩制成高温时的饱和溶液,然后进行降温处理,可以得到柠檬酸晶体和母液,再进行过滤,可以得到柠檬酸晶体,所以操作顺序是:b→c→a;
(6)活性炭有吸附性,可以吸附色素和异味,明矾可以做絮凝剂,使水中的小颗粒沉降,肥皂水可以检验硬水和软水,所以工业生产中,可加入活性炭进行脱色处理;
(7)硫酸钙表面会粘有柠檬酸,将滤渣洗涤后,表面的柠檬酸会进入滤液中,提高了柠檬酸的产量,所以洗涤CaSO4滤渣的目的是:提高产量;
(8)通过分析反应流程中的各种物质,可知得到柠檬酸晶体的母液,中含有一定的柠檬酸,可以在重新参与反应,所以母液可以循环,其中一定含有的溶质是:柠檬酸.
故答案为:(1)CO2+Ca(OH)2=CaCO3↓+H2O;
(2)使反应更充分进行;
(3)3H2SO4+Ca3(C6H5O7)2=3CaSO4↓+2C6H8O7,复分解;
(4)过滤,ac;
(5)c;
(6)活性炭;
(7)柠檬酸(或C6H8O7).
点评 在解此类题时,首先分析题中的反应流程,然后结合学过的知识、题中所给的知识以及题中的问题进行逐一的解答.


 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:推断题
查看答案和解析>>
科目:初中化学 来源: 题型:推断题
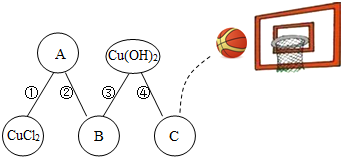 物质王国举行一场趣味篮球赛.某队由铁、二氧化碳、稀盐酸、氢氧化钙、氯化铜五名“队员”组成.比赛中,由“氯化铜队员”发球,“队员”间传接球,最后由C位置“队员”投篮进球完成有效进攻.传接球“队员”间必须能相互反应,场上“队员”位置及传球路线如图.
物质王国举行一场趣味篮球赛.某队由铁、二氧化碳、稀盐酸、氢氧化钙、氯化铜五名“队员”组成.比赛中,由“氯化铜队员”发球,“队员”间传接球,最后由C位置“队员”投篮进球完成有效进攻.传接球“队员”间必须能相互反应,场上“队员”位置及传球路线如图.查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com