
| A.26 | B.40 | C.58 | D.90 |
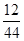 ×100%=12g,9g水中氢元素的质量=9g×
×100%=12g,9g水中氢元素的质量=9g×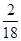 ×100%=1g,故碳、氢元素质量比=12g:1g=12:1。
×100%=1g,故碳、氢元素质量比=12g:1g=12:1。

科目:初中化学 来源:不详 题型:单选题
| A.因为洗洁精具有乳化功能,所以用于去除油污 |
| B.因为氢气的密度最小,所以用于做燃料 |
| C.因为钨的熔点高且能导电,所以用于制作白炽灯丝 |
| D.因为镁粉燃烧发出耀眼白光,所以用于制作照明弹 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com