
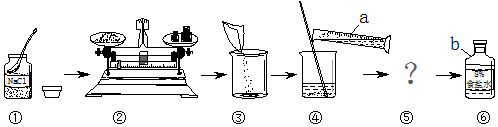
分析 熟练掌握溶液配制的过程及其注意事项,明确误差分析的影响要素,结合质量分数的计算式进行分析解答.
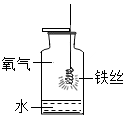
解答 解:(1)a为 量筒,b为 试剂瓶(或者细口瓶).
(2)写出图中的一处错误操作 只有操作①中瓶塞没有倒放.
(3)步骤⑤的操作为溶解,玻璃棒的作用是 加速溶解,其操作要领是 玻璃棒伸入溶液中旋转搅动,玻璃棒不碰触杯壁.
(4)若上面溶解得到的NaCl溶液中还含有少量不溶性物质,则步骤⑤还需增加的操作名称是 过滤;配制溶液时,量取水的时候仰视读数,仰视读数偏小,实际体积偏大,则配制的NaCl溶液的溶质质量分数 偏小.
故答案为:
(1)量筒; 试剂瓶;(2)操作①中瓶塞没有倒放.
(3)加速溶解;玻璃 棒伸入溶液中旋转搅动,玻璃棒棒不碰触杯壁.
(4)过滤;偏小.
点评 溶液的配制是初中常见的基本操作,也是考查的重点内容,注意多总结误差分析的影响因素及其对结果的影响.


科目:初中化学 来源: 题型:选择题
| A. | 都能通过化合反应实现 | B. | 都能通过置换反应实现 | ||
| C. | 都能通过与单质反应实现 | D. | 变化前后都有元素化合价发生改变 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 |  |  |  |
| A | B | C | D |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
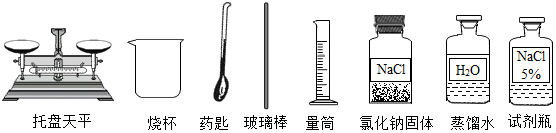
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题

查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
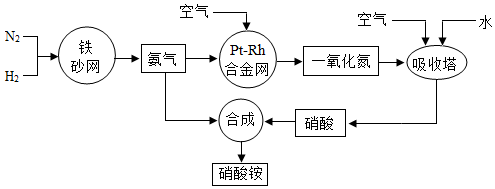
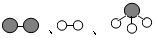 分别表示氮气、氢气和氨气.观察下图,写出符合在催化剂表面合成氨反应过程的正确顺序CEABD(将下面五张图按反应过程顺序用字母序号排列)
分别表示氮气、氢气和氨气.观察下图,写出符合在催化剂表面合成氨反应过程的正确顺序CEABD(将下面五张图按反应过程顺序用字母序号排列)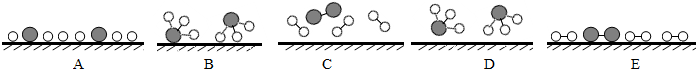
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com