某学生对久置于空气中已部分变质的氧化钙取样分析:取样品16.9g,加入溶质质量分数为20%的盐酸溶液109.5g,将生成的气体全部通过足量的Ba(OH)2溶液中,得到3.94g沉淀;在所得的澄清溶液中加入过量的Na2CO3溶液,产生672mLCO2(密度1.965g?L),并生成沉淀Wg.计算样品中CaO的质量分数及W的值.
解:(1)设样品中CaCO
3质量为x,与CaCO
3反应的盐酸为y
由方程式①CaCO
3+2HCl═CaCl
2+H
2O+CO
2↑ ②CO
2+Ba(OH)
2═BaCO
3↓+H
2O
可知有关系式:BaCO
3 ~CaCO
3 ~2HCl
197 100 73
3.94g x y
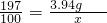
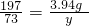
x=2g y=1.46g
所以样品中CaO和Ca(OH)
2的质量之和为:16.9g-2g=14.9g
由题意可知盐酸和样品反应后有剩余,而且剩余盐酸和Na
2CO
3反应产生的CO
2质量为:0.672L×1.965g/L=1.32g
设剩余HCl的质量为z
Na
2CO
3+2HCl═2NaCl+H
2O+CO
2↑
73 44
z 1.32g
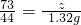
z=2.19g
因为总HCl的质量为:109.5g×20%=21.9g,所以可知与CaO和Ca(OH)
2反应的HCl为:21.9g-2.19g-1.46g=18.25g
设CaO质量为m,与CaO反应的HCl的质量为n;那么Ca(OH)
2的质量为14.9g-m,与Ca(OH)
2反应的HCl的质量为18.25g-n
CaO+2HCl═CaCl
2+H
2O Ca(OH)
2+2HCl═CaCl
2+H
2O
56 73 74 73
m n 14.9g-m 18.25g-n
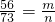
①
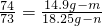
②
由①②解得:m=11.2g
所以氧化钙的质量分数为:
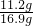
×100%=66.3%
(2)根据CaO、Ca(OH)
2、CaCO
3和HCl反应生成CaCl
2的化学方程式,及反应CaCl
2+Na
2CO
3═CaCO
3↓+2NaCl
可知有关系式:2HCl~CaCl
2~CaCO
3,
73 100
21.9g-2.19g W
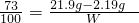
W=27g
答:样品中氧化钙的质量分数为66.3%,W的值为27g.
分析:氧化钙变质的过程是氧化钙和水反应生成氢氧化钙,氢氧化钙和二氧化碳反应生成碳酸钙.通过题意可知样品中有氧化钙和碳酸钙,另外利用氧化钙和盐酸反应的方程式,把用总盐酸减去剩余盐酸再减去和碳酸钙反应的盐酸后,所得的盐酸质量代入求解可知,样品中除碳酸钙外的其他成分不都是氧化钙,所以样品中应该含有氢氧化钙.
点评:此题考查的是利用化学方程式的计算,此题容易出错的地方是求出碳酸钙质量后,把用总质量减去碳酸钙质量后的质量都当成氧化钙质量.此题综合性较强,步骤比较多,是一道较难的计算题.

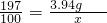
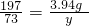
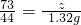 z=2.19g
z=2.19g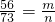 ①
①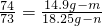 ②
②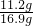 ×100%=66.3%
×100%=66.3%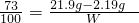 W=27g
W=27g

 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案 期末金牌卷系列答案
期末金牌卷系列答案