
碳酸钠,化学式Na2CO3,俗称纯碱.“纯碱中常常会混有少量的氯化钠”.某研究性学习小组以一包纯碱(若有杂质,只考虑为氯化钠)为研究对象,探究该纯碱样品中碳酸钠的含量.请你参与他们的活动.
[小组讨论]
观点Ⅰ:纯碱样品中只含有碳酸钠
观点Ⅱ:纯碱样品是由碳酸钠和少量氯化钠组成的混合物
[实验设计]
甲方案
Ⅰ设计思路:根据样品与石灰水反应生成沉淀碳酸钙的质量,求出碳酸钠的质量,再计算样品中碳酸钠的质量分数.
Ⅱ操作步骤:称取13.25 g纯碱样品,加入过量的澄清石灰水,充分搅拌.过滤、洗涤、干燥,得到白色沉淀10.00 g
Ⅲ数据处理:请根据上述实验数据,计算该样品中碳酸钠的质量分数.
计算过程:
Ⅳ实验结论:________.
乙方案
Ⅰ设计思路:根据样品(质量为a g)与稀硫酸完全反应生成二氧化碳的质量(质量为b g),求出碳酸钠的质量,再计算样品中碳酸钠的质量分数.
Ⅱ实验结论:
(1)当a、b的质量关系满足________(填写含a、b字母的表达式,下同)时,纯碱样品中只含有碳酸钠,样品中碳酸钠的质量分数是100﹪.
(2)当a、b的质量关系满足________时,纯碱样品是由碳酸钠和少量氯化钠组成的混合物,样品中碳酸钠的质量分数是________.
[实验评价]
误差分析:(1)甲方案中,白色沉淀的质量在过滤、干燥等操作过程中会有所损耗,造成计算结果与实际值相比偏小.(2)乙方案中,有部分生成的二氧化碳气体因溶解于水而没有全部逸出,造成计算结果与实际值相比________(填写“偏大”、 “偏小”或“不变”).
[交流反思]
(1)实验过程中,需用玻璃棒不断搅拌,该操作的目的是________.
(2)甲方案实验操作中,对沉淀洗涤的目的是:________.
(3)乙方案中,需用一定质量的19.6﹪的稀硫酸.现有一瓶98﹪的浓硫酸(密度为1.84 g/cm3),配制乙方案中实验所用稀硫酸,至少需要浓硫酸的体积是________mL(填写含字母的表达式).浓硫酸稀释的正确操作是________.
科目:初中化学 来源: 题型:
| +4 |
| C |
| +4 |
| C |
查看答案和解析>>
科目:初中化学 来源: 题型:
| +4 |
| S |
| +4 |
| S |
| ||
| ||
查看答案和解析>>
科目:初中化学 来源: 题型:
| +4 |
| C |
| +4 |
| C |
查看答案和解析>>
科目:初中化学 来源: 题型:
同学们在学习了盐的化学性质以后,开展了测定碳酸钠和氯化钠的固体混合物中碳酸钠的质量分数的探究实验,他们设计了以下实验方案
 【方案一】气体转化法
【方案一】气体转化法


图1 图2 图3
(1) 如下图1所示,把wg的混合物与足量稀硫酸反应后,测定产生的CO2的体积,检查该装置气密性的方法是
(2) 有同学提出用图2代替图1中的收集装置,则所测得CO2气体的体积
(填偏大、偏小或不变)理由是 ,你的改进方案是 ;广口瓶内原有的空气对实验结果___________(填“有”或“没有”)影响,如果利用改进后的装置测得CO2气体的体积为Vml (此时CO2的密度为Pg/ml)则原混合物中Na2CO3的质量分数的计算式为_________________
(3)也有人用图3装置测定CO2的质量(碱石灰的成分是CaO和NaOH的混合物)则图3实验装置中主要存在哪些缺陷?这些缺陷对实验结果有何影响?
| 主要缺陷 | 对实验结果的影响 |
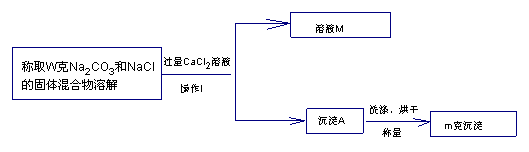 【方案二】沉淀法(如图所示)
【方案二】沉淀法(如图所示)
(1)沉淀A的化学式是_______________,溶液M中溶质的化学式是_______________
(2)确定CaCl2溶液是否过量的方法是_____________________________
(3)该固体混合物中Na2CO3的质量分数的计算式为_________________________
(4)导致测定结果偏大的原因可能是_________________________
【方案三】盐酸滴定法

(1)“操作2”的名称是______________
(2)根据实验数据计算该固体混合物中Na2CO3的质量分数为________(保留一位小数)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com