某研究性学习小组的同学在用硫酸溶液处理废锌片时发现产生的气体具有刺激性气味,同时发现试管外壁发烫,这种现象引起同学们的思考和研究.
查阅资料:①SO
2溶于水,它能与NaOH反应,生成Na
2SO
3;②H
2具有还原性.
分析讨论:根据试管发烫的现象分析,说明锌与硫酸发生的反应是
(填“吸热”或“放热”)反应.
提出猜想:对生成的气体进行猜想:
猜想1:可能是H
2;
猜想2:可能是SO
2,做出此猜想的理由是
;
猜想3:可能是H
2和SO
2的混合气体.
实验方案:研究性学习小组的同学设计了图1所示的装置进行探究(夹持仪器已省略,假设装置中的反应都进行完全)
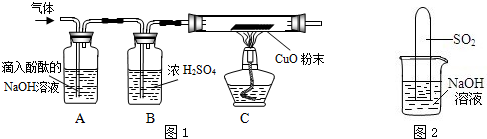
问题讨论:(1)如果装置A没有明显实验现象,装置C的现象为
,则猜想1成立.
(2)如果装置A的现象为溶液红色变浅,装置C没有明显实验现象,则猜想
成立.
(3)猜想3成立的实验现象是
.
(4)装置B中浓硫酸的作用是
.
实验反思:(1)实验室中可以用氢氧化钠溶液吸收二氧化硫,反应的化学方程式是
.
(2)小组内一同学又设计了判断SO
2与NaOH溶液能否发生反应的装置(如图2),实验时发现试管内液面上升,就得出SO
2与NaOH溶液发生反应的结论,其他同学认为这一结论不严谨,理由是
.要得到科学严谨的结论,仍利用该装置,需做的对比实验
.
拓展延伸:小组的同学欲证明试管内锌与硫酸反应后的溶液中是否有硫酸剩余,下列方法中错误的是
(填序号).
①往容器内再加稀盐酸,如有气泡产生,则溶液中没有硫酸
②往容器内再加锌粒,如有气泡产生,则溶液中一定有硫酸
③往容器内加氯化钡溶液,如有沉淀生成,则溶液中一定有硫酸
④将试管中剩余固体加入到硫酸铜溶液中,如有红色固体生成,则溶液中没有硫酸.

 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案