
| 坩埚质量 | 坩埚与晶体总质量 | 加热后坩埚与固体总质量 | 测得晶体中结晶水个数 |
| 20.5g | 45.5g | 36.5g |
分析 (1)根据反应前后的固体质量的差来计算水的质量;
(2)根据硫酸铜晶体的质量和生成结晶水的质量进行计算;
(3)根据CuSO 4.xH2O$\frac{\underline{\;\;△\;\;}}{\;}$CuSO 4+xH2O,利用硫酸铜的质量与水的质量代入方程式计算x;
(4)根据化学方程式的计算分析.
解答 解:(1)由表格中的数据,水的质量为反应前后固体质量的差,则水的质量为44.5g-35.5g=9g;
(2)硫酸铜晶体中结晶水的质量分数为:$\frac{9g}{45.5g-20.5g}$×100%=36%;
(3)由表格中的数据,硫酸铜的质量为:35.5g-19.5g=16g,
CuSO 4.xH2O$\frac{\underline{\;\;△\;\;}}{\;}$CuSO 4+xH2O,
160 18x
16g 9g
$\frac{160}{18x}=\frac{16g}{9g}$ 解得:x=5.
(4)①加热过程中有少量CuSO4粉末溅出,使得硫酸粉末的质量减少,计算出x偏大;
②加热后,坩埚放置在空气中冷却,硫酸铜粉末能与空气中的水分反应,使得硫酸粉末的质量增加,计算出x偏小.
故答为:(1)9;(2)36%;(3)5;(4)偏大,偏小.
点评 本题考查学生利用试验数据来分析数据并应用数据进行计算,较好的训练了学生对实验数据的分析应用能力,并应熟悉化学方程式及溶质质量分数的计算来解答.


 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案科目:初中化学 来源: 题型:填空题
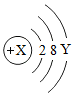 某粒子的结构示意图为
某粒子的结构示意图为查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 猜想 | 实验步骤 | 实验现象 | 结论与相应的化学方程式(若不反应,可不写化学方程式) |
| 可能是氢氧化钙溶液 | 方案1:用试管取约2mL该溶液,向其中滴加几滴Na2CO3溶液 | 该溶液是氢氧化钙溶液 化学方程式:Ca(OH)2+Na2CO3═CaCO3↓+2NaOH | |
| 方案2:(选用与方案1不同类别的其他物质) | 该溶液是氢氧化钙溶液 化学方程式:Ca(OH)2+CO2═CaCO3↓+H2O |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
 甲、乙两个实验小组分别进行“Na2CO3和NaCl混合物中Na2CO3含量测定”的实验:
甲、乙两个实验小组分别进行“Na2CO3和NaCl混合物中Na2CO3含量测定”的实验:查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
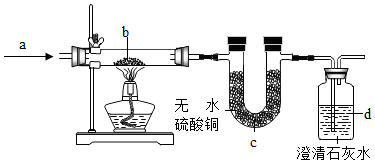
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题

查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 此操作违反规定,无法确定 | B. | 称量物的质量为9.2g | ||
| C. | 称量物的质量为8.2 g | D. | 称量物的质量为9g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com