
分析 反应前后的质量差即为反应生成氧气的质量,根据氧气的质量可以计算氯化钾的质量、反应的氯酸钾的质量,进一步可以计算二氧化锰的质量等.
解答 解:(1)加热氯酸钾与二氧化锰的混合粉末生成了氯化钾和氧气,反应的化学方程式:2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑;
(2)生成氧气的质量为:28.5g-18.9g=9.6g;
(3)设生成的氯化钾的质量为x,氯酸钾的质量为y,
2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑
245 149 96
y x 9.6g
$\frac{245}{96}=\frac{y}{9.6g}$ 解得:y=24.5g
求解氯化钾质量(X)的比例式为:$\frac{149}{96}=\frac{x}{9.6g}$ 解得:x=14.9g
(4)由以上计算可知,原固体粉末中氧酸钾的质量为24.5g;
(5)生成氯化钾占所得固体的质量分数为:$\frac{14.9g}{18.9g}×100%$≈78.9%;
(6)二氧化锰的质量为:18.9g-14.9g=4g;
(7)反应后所得固体中氯化钾与二氧化锰的质量比为:14.9g:4g=149:40
答案:(1)2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑;(2)9.6g;(3)$\frac{149}{96}=\frac{x}{9.6g}$;(4)24.5g;(5)78.9%;
(6)4g;(7)149:40.
点评 本题主要考查学生运用假设法和化学方程式进行计算和推断的能力,计算时要注意规范性和准确性


科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
 甲、乙两种固体纯净物的溶解度曲线如图A所示.
甲、乙两种固体纯净物的溶解度曲线如图A所示.查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
 小鹏与小明做完酸、碱、盐相关性质实验后,很感兴趣地把稀硫酸、氢氧化钠溶液和碳酸钠溶液混合一起,看到有大量气泡生成.他们对反应后溶液中溶质的成分很好奇,请你与他们一起进行探究.
小鹏与小明做完酸、碱、盐相关性质实验后,很感兴趣地把稀硫酸、氢氧化钠溶液和碳酸钠溶液混合一起,看到有大量气泡生成.他们对反应后溶液中溶质的成分很好奇,请你与他们一起进行探究.| 第一次 | 第二次 | 第三次 | 第四次 | 第五次 | |
| 加入纯碱样品的质量/g | 5.4 | 5.4 | 5.4 | 5.4 | 5.4 |
| 电子天平的示数/g | 163.2 | 166.4 | 169.6 | 175 | 180.4 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 A~G都是初中化学中常见的物质,已知B为黑色固体,C为胃酸主要成分,F和G为植物光合作用的原料.A、B、C、D、E分别为五种不同类别的物质,它们的转化关系如图所表(“一”表示相互能反应,“一”表示有转化关系).请回答:
A~G都是初中化学中常见的物质,已知B为黑色固体,C为胃酸主要成分,F和G为植物光合作用的原料.A、B、C、D、E分别为五种不同类别的物质,它们的转化关系如图所表(“一”表示相互能反应,“一”表示有转化关系).请回答:查看答案和解析>>
科目:初中化学 来源:2017届江苏省高邮市九年级下学期第一次网上阅卷适应性训练(一模)化学试卷(解析版) 题型:信息分析题
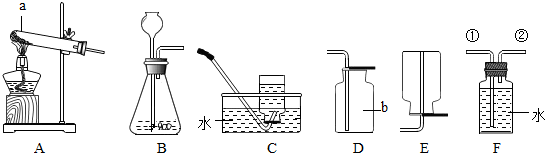
实验室可选用下图装置,制取二氧化碳气体和进行有关实验,回答下列问题:

(1)写出实验室用A装置制取二氧化碳的化学方程式___________。A中仪器X的名称为___________。
(2)欲除去制得气体中混有的氯化氢气体,常把A装置与盛有饱和碳酸氢钠溶液的D装置连接,反应的化学方程式为_____________。
(3)D装置装入液体__________(填名称)可以干燥二氧化碳。
(4)用E装置收集二氧化碳,则气体应从___________端(填a或b)通入,验满方法是___________。
(5)F装置是医用输液观察滴液快慢的滴壶,若用它作微型实验装置检验二氧化碳,其中盛装的溶液是___________(填名称),气体应从_____________(填c或d)端通入,其中所装的液体_____________(填“能”或“不能”)装满。反应的化学方程式为_____________。
查看答案和解析>>
科目:初中化学 来源:2017届江苏省高邮市九年级下学期第一次网上阅卷适应性训练(一模)化学试卷(解析版) 题型:选择填充题
下列物质能与稀盐酸反应生成氢气的是
A. 铜 B. 银 C. 碳酸钙 D. 铁
查看答案和解析>>
科目:初中化学 来源:2016-2017学年黑龙江省大庆市杜尔伯特蒙古族自治县八年级(五四制)下学期期中考试化学试卷(解析版) 题型:选择填充题
元素的原子结构示意图为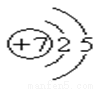 ,请你根据以下各元素的原子结构示意图判断,与氮元素具有相似化学性质的是 ( )
,请你根据以下各元素的原子结构示意图判断,与氮元素具有相似化学性质的是 ( )
A. 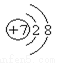 B.
B. 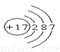 C.
C.  D.
D. 
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com