
分析 根据二氧化碳的体积和密度可求出二氧化碳的质量,根据生成的二氧化碳的质量和化学方程式可求出反应物菱铁矿中碳酸亚铁的质量分数.
解答 解:生成的质量11.2L×1.97g/L=22.1g,
设该菱铁矿中FeCO3的质量为x
FeCO3+2HCl=FeCl2+CO2↑+H2O
116 44
x 22.1g
$\frac{116}{x}$=$\frac{44}{22g}$
x=58.3g≈58g
所以在菱铁粉中百分含量为:$\frac{58.3g}{100g}$×100%=58.3%≈58%.
答:该矿石粉中纸碳酸亚铁的质量是58g,在菱铁粉中百分含量是58%.
点评 本题是有关化学方程式的计算和质量分数的计算有一点难度,需同学们认真、细心.


 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案科目:初中化学 来源: 题型:选择题
| A. | 氧化铜和氢氧化铜 | B. | 氧化铜和铜 | ||
| C. | 铜和氢氧化铜 | D. | 碳酸铜和氢氧化铜 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
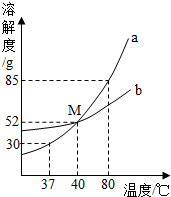 如图为a、b两种物质的溶解度曲线.请根据图中内容回答下列问题:
如图为a、b两种物质的溶解度曲线.请根据图中内容回答下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
 如图所示,弹簧测力计下挂一重物A,烧杯中盛有溶液B.试根据要求回答下列问题(忽略A、B体积变化):
如图所示,弹簧测力计下挂一重物A,烧杯中盛有溶液B.试根据要求回答下列问题(忽略A、B体积变化):查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com