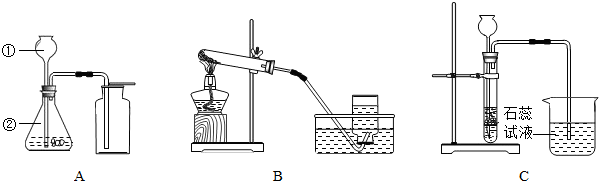
解:(1)上述标号的仪器名称:①长颈漏斗;②锥形瓶;
(2)①因为氧气不易溶于水,故可用排水集气法收集氧气.故选B;
②用氯酸钾和二氧化锰固体制取O
2的化学方程式为:2KClO
3
2KCl+3O
2↑;
③为了防止导致导管倒吸水,炸裂试管,当O
2收集满并取出集气瓶后,停止该实验的正确操作方法是:先把导管移出水面,后熄灭酒精灯;
(3)①因为大理石的主要成份是碳酸钙,与盐酸反应生成氯化钙、水和二氧化碳,水和二氧化碳反应可生成碳酸,石蕊试液遇酸变红色;
②盐酸易挥发出氯化氢气体,氯化氢气体溶于水形成盐酸,使石蕊试液变红色;
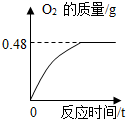
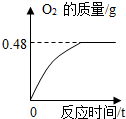
(4)①完全反应后生成氧气的物质的量为:0.48g÷32=0.015mol;
②设该过氧化氢溶液的溶质质量为x,
2H
2O
2
2H
2O+O
2↑
68 32
x 0.48g
∴
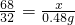
∴x=
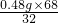
=1.02g,
过氧化氢溶液的溶质质量分数为:

×100%=2%.
故答案为:(1)长颈漏斗;锥形瓶;
(2)B;2KClO
3
2KCl+3O
2↑;先把导管移出水面,后熄灭酒精灯;
(3)①产生的CO
2与H
2O反应生成H
2CO
3,使石蕊试液变红;②挥发出的氯化氢溶于水使石蕊试液变红;
(4)0.015mol;2%.
分析:(1)根据实验操作经验.写出仪器名称;
(2)①排水集气法适用于不易跟水发生反应,难溶于水的气体;
②用氯酸钾和二氧化锰固体制取O
2,二氧化锰是催化剂,氯酸钾受热分解为氯化钾和氧气,据此写出化学方程式即可;
③如果先熄灭酒精灯,再把导管移出水面,会导致导管倒吸水,炸裂试管;
(3)石蕊试液遇酸变红色,遇碱变蓝色;盐酸有挥发性;
(4)①单位物质的量的物质所具有的质量,称为摩尔质量,在数值上等于该物质的相对原子质量或相对分子质量;
②根据过氧化氢分解的化学方程式和生成氧气的质量,列出比例式,就可计算出该过氧化氢溶液的溶质质量,然后根据溶质质量分数公式计算即可.
点评:本题主要考查学生运用所学化学知识综合分析和解决实际问题的能力.增加了学生分析问题的思维跨度,强调了学生整合知识的能力.



 2KCl+3O2↑;
2KCl+3O2↑; 2H2O+O2↑
2H2O+O2↑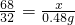
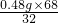 =1.02g,
=1.02g, ×100%=2%.
×100%=2%. 2KCl+3O2↑;先把导管移出水面,后熄灭酒精灯;
2KCl+3O2↑;先把导管移出水面,后熄灭酒精灯;