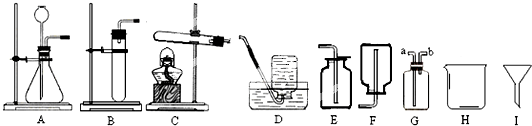
考点:常用气体的发生装置和收集装置与选取方法,实验室制取氧气的反应原理,氧气的检验和验满,制取氧气的操作步骤和注意点,二氧化碳的实验室制法,二氧化碳的检验和验满,碳的化学性质,根据化学反应方程式的计算
专题:有关化学方程式的计算,常见气体的实验室制法、检验、干燥与净化
分析:烧杯可以做较多量液体的反应容器,漏斗是过滤用的仪器;制取装置包括加热和不需加热两种,如果用双氧水和二氧化锰制氧气就不需要加热,如果用高锰酸钾或氯酸钾制氧气就需要加热.氧气的密度比空气的密度大,不易溶于水,因此能用向上排空气法和排水法收集;用排水法收集较纯净氧气的适宜时间是:当导管口有连续均匀气泡冒出时;实验结束应先移出导管,后熄灭酒精灯,其原因是:防止水倒流,使试管炸裂.实验室制取CO2,是在常温下,用碳酸钙和盐酸互相交换成分生成氯化钙和水和二氧化碳,因此不需要加热.二氧化碳能溶于水,密度比空气的密度大,因此只能用向上排空气法收集;二氧化碳的验满方法是:将一根燃着的木条平放在集气瓶口,木条熄灭,证明满了.若用C装置进行木炭还原氧化铜实验,酒精灯需加一个金属网罩,其目的是使火焰温度集中,提高温度;碳和氧化铜在高温的条件下生成铜和二氧化碳,配平即可.若用装置F收集某气体,该气体应具备的性质是:密度小于空气.用加热氯化铵和消石灰的固体混合物制取氨气,因此需要加热;若选用G装置收集氨气,应从短管进入,因为氨气的密度比空气的密度小;为防止多余的氨气逸出到空气中,采取的措施是:烧杯内盛水,把a导管和漏斗用一胶皮管相连,然后把漏斗倒扣在水面上,用水把多余的氨气吸收掉.
解答:解:(1)烧杯可以做较多量液体的反应容器,漏斗是过滤用的仪器,故答案为:烧杯;漏斗;
(2)实验室制取CO
2,是在常温下,用碳酸钙和盐酸互相交换成分生成氯化钙和水和二氧化碳,因此不需要加热.二氧化碳能溶于水,密度比空气的密度大,因此只能用向上排空气法收集;二氧化碳的验满方法是:将一根燃着的木条平放在集气瓶口,木条熄灭,证明满了;A与B相比,优点是添加液体比较方便;故答案为:AE或BE;CaCO
3+2HCl=CaCl
2+H
2O+CO
2↑;将一根燃着的木条平放在集气瓶口,木条熄灭,证明满了;添加液体比较方便;
(3)如果用高锰酸钾制氧气就需要加热,高锰酸钾受热分解生成锰酸钾和二氧化锰和氧气,要注意配平;装药品前应进行的操作是检查装置的气密性;用排水法收集较纯净氧气的适宜时间是:当导管口有连续均匀气泡冒出时;实验结束应先移出导管,后熄灭酒精灯,其原因是:防止水倒流,使试管炸裂.故答案为:C;2KMnO
4K
2MnO
4+MnO
2+O
2↑;检查装置的气密性;气体从瓶口向外冒出时;先撤导管,后熄灭酒精灯;
(4)若用C装置进行木炭还原氧化铜实验,酒精灯需加一个金属网罩,其目的是使火焰温度集中,提高温度;碳和氧化铜在高温的条件下生成铜和二氧化碳,配平即可,故答案为:使火焰温度集中,提高温度;C+2CuO
2Cu+CO
2↑;
(5)若用装置F收集某气体,该气体应具备的性质是:密度小于空气,故答案为:密度小于空气
(6)用加热氯化铵和消石灰的固体混合物制取氨气,因此需要加热;若选用G装置收集氨气,应从短管进入,因为氨气的密度比空气的密度小;为防止多余的氨气逸出到空气中,采取的措施是:烧杯内盛水,把a导管和漏斗用一胶皮管相连,然后把漏斗倒扣在水面上,用水把多余的氨气吸收掉;故答案为:C;b;烧杯内盛水,把a导管和漏斗用一胶皮管相连,然后把漏斗倒扣在水面上,用水把多余的氨气吸收掉;
(7)根据质量守恒定律可知,二氧化碳的质量=12.5g+50g-58.1g=4.4g;
设碳酸钙的质量分数为x
CaCO
3+2HCl=CaCl
2+H
2O+CO
2↑
100 44
12.5g.x 4.4g
= x=80%
答:碳酸钙的质量分数80%;
故答案为:80%;
点评:本考点主要考查了仪器的名称、气体的制取装置和收集装置的选择,同时也考查了化学方程式的书写和根据化学方程式的计算等,综合性比较强.气体的制取装置的选择与反应物的状态和反应的条件有关;气体的收集装置的选择与气体的密度和溶解性有关,有关的计算要准确.本考点是中考的重要考点之一,主要出现在实验题中.