
| 反应前 | 反应后 | |
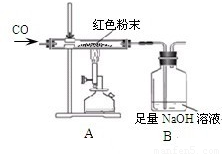
| Ⅰ 组 | 玻璃管和红色粉末的总质量为48.3g | 玻璃管和固体物质的总质量为47.1g |
| Ⅱ 组 | 洗气瓶和瓶中所盛物质的总质量为258.6g | 洗气瓶和瓶中所盛物质的总质量为261.9g |
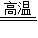 2Fe+3CO2.
2Fe+3CO2.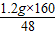 =4g,则氧化铁的质量分数为
=4g,则氧化铁的质量分数为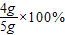 =80%.
=80%.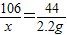
 2Fe+3CO2.
2Fe+3CO2.

科目:初中化学 来源: 题型:阅读理解
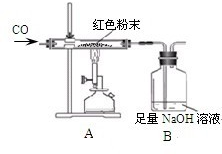 周三的化学兴趣活动中,小吴同学拿出一包干燥的红色粉末,同学们对其组成进行探究.根据该红色粉末的来源,老师判断其可能由Cu、Fe2O3两种固体中的一种或两种组成.
周三的化学兴趣活动中,小吴同学拿出一包干燥的红色粉末,同学们对其组成进行探究.根据该红色粉末的来源,老师判断其可能由Cu、Fe2O3两种固体中的一种或两种组成.| 反应前 | 反应后 | |
| Ⅰ 组 |
玻璃管和红色粉末的总质量为48.3g | 玻璃管和固体物质的总质量为47.1g |
| Ⅱ 组 |
洗气瓶和瓶中所盛物质的总质量为258.6g | 洗气瓶和瓶中所盛物质的总质量为261.9g |
| ||
| ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com