(1)某元素的符号为R,相对原子质量为a,其0.5ag单质可跟20g氧完全反应生成氧化物,则此氧化物的化学式为______.假设此氧化物是酸性氧化物则它所形成的酸的化学式可能是①HRO、②HRO2、③HRO3、④H2RO3、⑤H2 RO4、⑥H3RO4.中的______(填序号入).
(2)为测定硫酸铵和氯化铵混合物中氯化铵的质量分数,甲、乙两位同学按下列实验步骤进行实验:称量样品→溶解→加过量试剂A→过滤出沉淀B→洗涤沉淀→烘干称量→处理实验数据并得出结果
1)实验时,甲同学选用硝酸银溶液作试剂A,乙同学选用氯化钡溶液作试剂A,其中______同学所选择的试剂A不合理,理由是______.
2)以下都是在试剂A选择正确时进行的实验:
①为进行称量、溶解、反应、过滤、洗涤沉淀的各项操作,准备了以下仪器:托盘天平与砝码、烧杯、过滤器、铁架台及附件、胶头滴管、量筒.其中还缺少的一件必备的仪器是______.
②若过滤所得沉淀未经洗涤即烘干称量,测定结果将______(填“偏高”、“偏低”).
③若实验测得混合物的质量为w克,沉淀物的质量为m克,实验测定的氯化铵质量分数的计算式=______.
【答案】
分析:(1)可用假设法解答本题,假设R和O
2的分子数,根据已知条件,列出比例式进行计算,就可得出R和O
2的个数比,据此得出此氧化物的化学式,根据“在化合物里,正负化合价代数和为0”计算出R的化合价,进而得出它所形成的酸的化学式.
(2)(1)根据实验步骤,所加入的试剂A应只能与硫酸铵和氯化铵混合物中一种物质反应生成沉淀,据此利用所选用试剂A的性质分析;
(2)①根据实验过程中的每个操作所需要使用的仪器,判断所准备的仪器中还缺少的仪器;
②过滤出的沉淀未经洗涤,在其表面残留的溶液在烘干过程中析出的溶质使沉淀质量偏大,根据数据的处理方法,判断这一误差对结果的影响;
③根据反应中硫酸铵与生成沉淀硫酸钡的质量关系,由测得沉淀硫酸钡的质量计算出混合物中硫酸铵的质量,从而完成混合物中氯化铵质量分数的计算.
解答:解:(1):设R和O
2反应的分子数分别为x和y;
设xR~yO
2
ax 32y
0.5ag 20g
∴
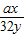
=
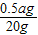
∴

所以反应的化学方程式为:4R+5O
2=2R
2O
5;因为在化合物里,正负化合价代数和为0,所以R的化合价为+5价,则它所形成的酸的化学式符合的是③HRO
3,⑥H
3RO
4.
(2):(1)硝酸银能与氯化铵反应生成氯化银的沉淀,又能与硫酸铵反应生成微溶的硫酸银,会致使测定结果出现较大的偏差;而氯化钡只与硫酸铵反应生成硫酸钡沉淀,可以完成测定的目的;
(2)①称量、溶解、反应、过滤、洗涤沉淀的各项操作中使用最多的一种仪器玻璃棒在所准备的仪器没有出现,因此,为完成该测定实验还缺少的必备仪器为玻璃棒;
②残留在沉淀表面的溶液在烘干过程中析出的固体溶质使沉淀质量偏大,因此根据沉淀质量所计算出的硫酸铵的质量也偏大,则使混合物氯化铵的质量及质量分数均偏低;
③设混合物中硫酸铵的质量为x
(NH
4)
2SO
4+BaCl
2═BaSO
4↓+2NH
4Cl
132 233
x m
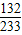
=
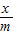
x=
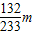
实验测定的氯化铵质量分数=
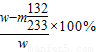
故答案为:(1)R
2O
5;③⑥;
(2)
(1)甲;AgNO
3既可以与NH
4Cl反应生成AgCl白色沉淀,又可与(NH
4)
2SO
4反应生成微溶的Ag
2SO
4,达不到良好的分离效果.
(2)①玻璃棒; ②偏低; ③
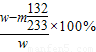
;
点评:通过对题目的分析,准确把握实验的目的与操作方法,此为解答此类实验问题的关键.

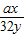 =
=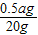

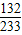 =
=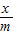
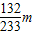
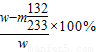
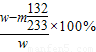 ;
;

 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案 (1)元素的化学性质主要与原子的
(1)元素的化学性质主要与原子的