取一定量25%的氢氧化钠溶液,将其蒸发掉12g水后,溶液中溶质的质量分数变为40%,再向其中加入一定质量的硫酸铜溶液,恰好完全反应,所得溶液中溶质的质量分数为20%.求加入的硫酸铜溶液中溶质的质量分数.(计算结果精确到0.1%)
【答案】
分析:根据溶液在蒸发过程中溶质不变求出氢氧化钠的质量和水的质量,硫酸铜与一定量的氢氧化钠溶液恰好完全反应,所得溶液为硫酸钠溶液,根据反应的化学方程式,由硫酸钠的质量可计算样品中硫酸铜的质量及所消耗氢氧化钠溶液中;
(1)样品中硫酸铜的质量分数=

×100%
(2)加入氢氧化钠溶液的溶质质量分数=
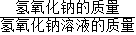
×100%,其中氢氧化钠溶液的质量可利用质量守恒定律求得.
解答:解:设25%的氢氧化钠溶液的质量为mg.
mg25%=(mg-12g)40%
m=32g
设硫酸铜溶液的质量为χ,生成硫酸钠的质量为y.生成的氢氧化铜的质量为z
2NaOH+CuSO
4═Na
2SO
4+Cu(OH)
2↓
80 160 142 98
32g25% χ y z
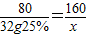
=
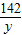
=
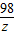
x=16g
y=14.2g
z=9.8g
硫酸钠溶液的质量为14.2g÷20%=71g
则硫酸铜溶液的质量为32g-12g+71g-9.8g=81.2g
硫酸铜溶液的质量分数为
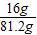
×100%=19.7%
答:硫酸铜溶液的溶质质量分数为19.7%.
故答案为:19.7%.
点评:根据化学方程式找出已知量和未知量的关系列比例式求解问题的能力及溶液中溶质质量分数的计算问题.这种题目难度较大,只要考查学生综合知识的运用能力.

 ×100%
×100%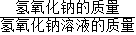 ×100%,其中氢氧化钠溶液的质量可利用质量守恒定律求得.
×100%,其中氢氧化钠溶液的质量可利用质量守恒定律求得.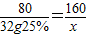 =
=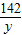 =
=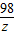
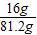 ×100%=19.7%
×100%=19.7% 

 名校课堂系列答案
名校课堂系列答案