

分析 (1)根据金属制品的用途分析性质;
(2)根据炼铁的原理写出反应的化学方程式;
(3)要设计实验验证金属的活动性强弱,可以依据金属活动性顺序的意义进行,根据金属与盐溶液的反应特点进行分析解答即可.
解答 解:(1)金属具有良好的导热性,可以用来制作炊具,所以,主要利用金属导热性的是AB;
(2)一氧化碳具有还原性,能与氧化铁反应生成铁和二氧化碳,所以工业上用赤铁矿(主要成分是氧化铁)冶炼铁的化学方程式是:3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2.
(3)欲探究锌,铁和铜的金属活动性顺序,可以利用金属与盐溶液能否反应来进行选择药品.由于三种的金属的活动性大小是锌>铁>铜,可以利用”三取中“的方法,所以选择的一组试剂是铁片,硫酸锌溶液和硫酸铜溶液,反应的现象是:铁片表面有红色物质析出,溶液由蓝色变为无色.
故答为:(1)AB;(2)3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2;铁片,硫酸锌溶液和硫酸铜溶液 铁片表面有红色物质析出,溶液由蓝色变为无色
点评 本题考查了常见金属的应用,完成此题,可以依据金属的性质进行.


 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:初中化学 来源: 题型:填空题
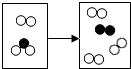 如图是密闭体系中某反应的微观示意图,“
如图是密闭体系中某反应的微观示意图,“ ”和“
”和“ ”分别表示微粒.
”分别表示微粒. B、
B、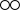 C、
C、 D、
D、
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 物质D属于氧化物 | B. | 物质C的水溶液pH大于7 | ||
| C. | 甲属于复分解反应 | D. | 实验室可用H2O2和MnO2制取E |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 样品质量 | 反应前总质量 | 反应后总质量 |
| 10.6克 | 148.5克 | 146.3克 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | X>Y>Z | B. | X>Z>Y | C. | Y>Z>X | D. | Z>Y>X |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
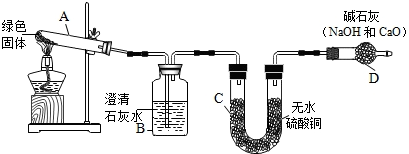
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com