
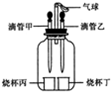
 如图所示装置(气密性良好),改变滴管和小烧杯中的物质可以完成多个简单实验.
如图所示装置(气密性良好),改变滴管和小烧杯中的物质可以完成多个简单实验.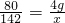 解得X=7.1g,答:参加反应的氢氧化钠溶液中溶质质量为4g,生成硫酸钠的质量为7.1g.
解得X=7.1g,答:参加反应的氢氧化钠溶液中溶质质量为4g,生成硫酸钠的质量为7.1g.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案科目:初中化学 来源: 题型:阅读理解
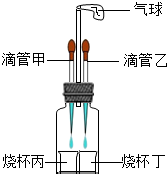 (2013?平顶山二模)如图所示装置(气密性良好),改变滴管和小烧杯中的物质可以完成多个简单实验.
(2013?平顶山二模)如图所示装置(气密性良好),改变滴管和小烧杯中的物质可以完成多个简单实验.查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
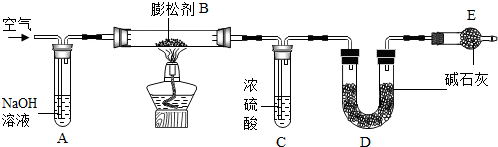
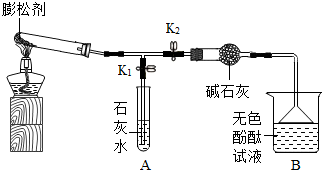 (2013?南安市质检)膨松剂是一种食品添加剂.它在面包制作过程中发生反应产生气体,使面包变得松软.膨松剂反应产生气体的量作为检验膨松剂品质的一项重要指标.已知某膨松剂含碳酸氢钠、碳酸氢铵(NH4HCO3)中的一种或两种,化学兴趣小组对它进行如下探究:
(2013?南安市质检)膨松剂是一种食品添加剂.它在面包制作过程中发生反应产生气体,使面包变得松软.膨松剂反应产生气体的量作为检验膨松剂品质的一项重要指标.已知某膨松剂含碳酸氢钠、碳酸氢铵(NH4HCO3)中的一种或两种,化学兴趣小组对它进行如下探究:
| ||
| ||
| 实验操作 | 主要实验现象 | 实验结论及解释 | |
| ① | 点燃酒精灯. 打开K1,关闭K2. |
试管中白色固体减少, 石灰水变浑浊 石灰水变浑浊 |
有二氧化碳生成,A中反应的化学方程式为 CO2+Ca(OH)2=CaCO3↓+H2O CO2+Ca(OH)2=CaCO3↓+H2O . |
| ② | 打开K2,关闭K1. | 无色酚酞试液变 红 红 色 |
有氨气生成. |
| ③ | 继续充分加热. | 试管中仍有固体 | 试管中有不分解的固体 |
查看答案和解析>>
科目:初中化学 来源: 题型:
 用分子或原子观点解释下列现象
用分子或原子观点解释下列现象查看答案和解析>>
科目:初中化学 来源: 题型:
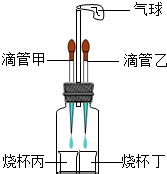 (2012?武汉模拟)如图所示装置(气密性良好),改变滴管和小烧杯中的物质可以完成多个简单实验.
(2012?武汉模拟)如图所示装置(气密性良好),改变滴管和小烧杯中的物质可以完成多个简单实验.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com