
 金属与人类的生产生活密切相关,牢固掌握金属的知识十分必要.
金属与人类的生产生活密切相关,牢固掌握金属的知识十分必要.分析 (1)考虑铁良好的导热性;
(2)根据金属活动顺序进行思考,Ag、Fe、Cu这三种金属的金属活动性由强到弱的顺序为Fe>Cu>Ag.在金属活动顺序表中,前边的金属可以把后边的金属从其盐溶液中置换出来,所以可以选择相应的金属和盐溶液进行反应来证明这三种金属的活动性强弱.
(3)根据工业炼铁中焦炭的作用,工业炼铁是利用了在高温下和氧化铁反应生成铁和二氧化碳,进行分析解答.
(4)根据金属活动顺序表知:锌>铜>银,所以加入锌粉,首先锌粉和硝酸银溶液反应,置换出单质银,如果锌粉足量可以再继续和硝酸铜反应置换出铜,若滤液中只含有一种溶质,说明溶液中只含有硝酸锌,滤渣中一定含有铜和银,可能含有锌;若滤渣中只含有两种金属,应该是铜和银,所以滤液中一定含有的金属离子是锌离子进行分析.
(5)若向其中一份中加入足量的稀盐酸,充分反应后应得到0.4g不溶物,说明其中一份铁粉中含杂质0.4g;向另一份中加入足量的氯化铜溶液,充分反应得到不溶物3.5g,所得不溶物为铜与铁粉中杂质的混合物,则铜的质量=3.5g-0.4g=3.1g;根据生成铜的质量,由反应的化学方程式,可计算中其中一份铁粉中铁的质量,所计算质量与杂质质量和的2倍即为原样品中铁粉的质量.
解答 解:(1)铁锅作炊具,是利用了铁良好的导热性.故填:d.
(2)①Fe、Ag、CueSO4溶液这三种物质中,Fe与CuSO4溶液反应,证明铁的活动性比铜强,Ag与CuSO4溶液不能反应,证明铜比银的活动性强.所以,所选试剂组可行;
②因为铁的活动性在三种金属中最强,所以Cu,Ag都不能和FeSO4溶液反应,得不出Cu,Ag的活动性强弱,所以此试剂组不可行;
③Cu、FeSO4溶液、AgNO3溶液这三种物质中,Cu与FeSO4溶液不反应,证明铁的活动性比铜强,Cu与AgNO3溶液能反应,证明铜比银的活动性强,可以证明三种金属的活动性强弱,此试剂组可行.
故选①③.
(3)工业炼铁中利用了焦炭的可燃性,提供热量;又利用其还原性,与二氧化碳反应生成一氧化碳气体.
工业上用一氧化碳还原氧化铁炼铁,主要是利用CO的还原性,在高温下和氧化铁反应生成铁和二氧化碳,反应的化学方程式为Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2.
(4)由题意可知金属活动性顺序可知,锌>铜>银.向含有AgNO3、Cu(NO3)2的混合液中加入一定量的锌粉,锌粉会首先置换硝酸银中的银,待硝酸银完全反应后继续与硝酸铜发生反应,若滤液中只含有一种溶质,说明溶液中只含有硝酸锌,滤渣中一定含有铜和银,可能含有锌;若滤渣中只含有两种金属,应该是铜和银,所以滤液中的成分是硝酸锌.
(5)由于两次混合物中不溶物的质量差为3.5g-0.4g=3.1g,所以为生成的铜的质量.
设与氯化铜溶液反应的铁粉质量为x.
Fe+CuCl2═FeCl2+Cu
56 64
x 3.1g
则$\frac{56}{64}=\frac{x}{3.1g}$,解得x≈2.7g.
原样品中铁粉的质量=2.7g×2=5.4g
答:原样品中铁粉的质量为5.4g.
故答案为:
(1)d;(2)①③;(3)生成一氧化碳气体;Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2.
(4)①一定含有铜和银,可能含有锌;②硝酸锌;(5)5.4g.
点评 要会利用金属活动顺序表设计实验,去验证金属的活动性强弱.氢前边的金属会与酸反应,但氢后边的金属不会与酸反应,前边的金属会把后边的金属从其盐溶液中置换出来.但也要注意,与金属反应酸一般是指稀硫酸和盐酸,不包括浓硫酸和硝酸.


科目:初中化学 来源: 题型:填空题
| 化学符号 | 2H | 2N2 | Mg2+ | H2O | 2CO32- | 2H2 |
| 符号的 意义 | 2个氢原子 | 2个氮分子 | 镁离子 | 水 | 2个碳酸根离子 | 2个氢分子 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 气体 | 所含杂质 | 除杂方法 | |
| A | H2 | 水蒸气 | 通过浓硫酸 |
| B | O2 | N2 | 通过灼热的铜网 |
| C | CO2 | 水蒸气 | 通过NaOH溶液 |
| D | CO2 | CO | 通过氧气点燃 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 青蒿素不属于氧化物 | B. | 青蒿素中氢元素的质量分数最大 | ||
| C. | 青蒿素由碳、氢、氧三种元素组成 | D. | 一个青蒿素分子共有42个原子 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
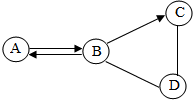 A、B、C、D为初中化学常见四种不同类别的化合物,它们之间有如图所示的转化和反应关系“→”表示某一种物质经一步反应可转化为另一种物质,“-”表示相连两种物质能发生化学反应,部分反应物、生成物及反应条件已略去).C在生活中可用来除油污,且C的固体可作某些气体的干燥剂,则C俗名是烧碱;A的用途为灭火;写出B→C转化的化学方程式:Na2CO3+Ca(OH)2=CaCO3↓+2NaOH.
A、B、C、D为初中化学常见四种不同类别的化合物,它们之间有如图所示的转化和反应关系“→”表示某一种物质经一步反应可转化为另一种物质,“-”表示相连两种物质能发生化学反应,部分反应物、生成物及反应条件已略去).C在生活中可用来除油污,且C的固体可作某些气体的干燥剂,则C俗名是烧碱;A的用途为灭火;写出B→C转化的化学方程式:Na2CO3+Ca(OH)2=CaCO3↓+2NaOH.查看答案和解析>>
科目:初中化学 来源: 题型:解答题
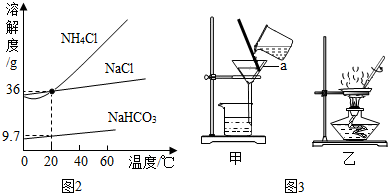
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 用水无法区分硝酸铵、氯化钠、氢氧化钠三种固体 | |
| B. | 铅锑合金熔点高,用来制作保险丝 | |
| C. | 组装观察水的沸腾的实验装置时,应按照先上后下的顺序来组装 | |
| D. | 某化肥与碱混合研磨,产生刺激性气味的气体,证明该化肥是铵态氮肥 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 诺氟沙星胶囊适用于肠道感染、尿路感染及其它沙门感染.右图是消炎药诺氟沙星胶囊的说明书.请阅读说明书回答以下问题:
诺氟沙星胶囊适用于肠道感染、尿路感染及其它沙门感染.右图是消炎药诺氟沙星胶囊的说明书.请阅读说明书回答以下问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com