
| A、Al2O3读作“氧化铝” | ||||
| B、五氧化二磷的化学式写成“O5P2” | ||||
C、2H2+O2
| ||||
| D、尿素[CO(NH2)2]相对分子质量的计算式写成“12+16+14+1×2×2=46” |


 智能训练练测考系列答案
智能训练练测考系列答案 计算高手系列答案
计算高手系列答案科目:初中化学 来源: 题型:阅读理解
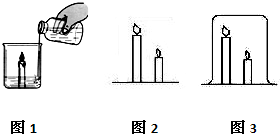 24、在高效课堂中,老师和同学们一起对“灭火的原理”进行了探究学习.
24、在高效课堂中,老师和同学们一起对“灭火的原理”进行了探究学习.| 实验步骤 | 实验现象 | 实验结论 |
将呼出的气体通过灼热的铜丝 |
铜丝变黑 |
人呼出的气体中存在氧气 |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
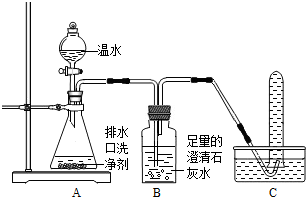
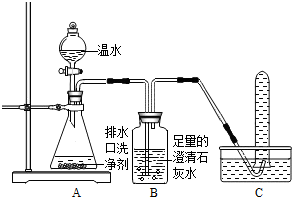 (2013?潍城区二模)小强同学看到妈妈将买来的排水口洗净剂(主要成分:过碳酸钠、柠檬酸)洒在厨房排水口网状盖的底部,倒上温水后迅速冒出气泡.为了解其反应过程,他与学习小组的同学进行了如下探究.
(2013?潍城区二模)小强同学看到妈妈将买来的排水口洗净剂(主要成分:过碳酸钠、柠檬酸)洒在厨房排水口网状盖的底部,倒上温水后迅速冒出气泡.为了解其反应过程,他与学习小组的同学进行了如下探究.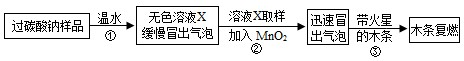
| 实验操作 | 主要实验现象 | 结论 |
| ① | 证明溶液中有Na2CO3 | |
| ② | 证明溶液中无NaHCO3 | |
| ③ | 证明溶液中无NaOH |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
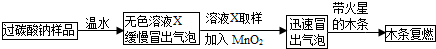
| 实验步骤 | 实验现象 | 实验结论 |
| a.取上述无色液体X少量于 试管中,至不再冒气泡为止, 加入足量的氯化钙溶液. |
产生白色沉淀 | 无色溶液X中含有 Na2CO3 Na2CO3 |
| b.取步骤a所得上层清液少量,滴加 稀盐酸 稀盐酸 |
没有气泡产生 没有气泡产生 |
无色溶液X中不含 NaHCO3 NaHCO3 |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
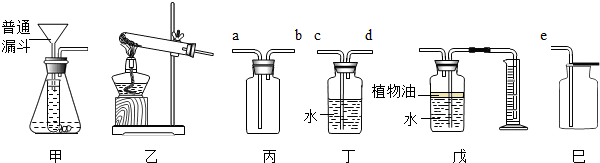
| ||
| ||
| 实验步骤 | 实验现象和结论 |
取两支试管分别等质量的二氧化锰,再加入不同质量的过氧化氢溶液 取两支试管分别等质量的二氧化锰,再加入不同质量的过氧化氢溶液 |
过氧化氢溶液多的反应剧烈,因此过氧化氢多,瞬间产生的气体多 过氧化氢溶液多的反应剧烈,因此过氧化氢多,瞬间产生的气体多 |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
| 实验步骤及操作方法 | 预期的实验现象 | 结论 |
| 取少量过氧化钙放入试管中,加足量水,振荡, 静置,取上层清液,通入二氧化碳气体(或滴加酚酞试液) 静置,取上层清液,通入二氧化碳气体(或滴加酚酞试液) . |
清液变浑浊(或变为红色) 清液变浑浊(或变为红色) |
有氢氧化钙产生 |
| 实验的装置 | 实验的主要过程 |
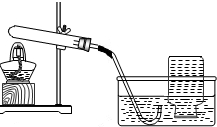 |
a.检查装置的气密性.操作如下:先 将导气管放入水中 将导气管放入水中 ,再用手紧握试管, 观察到 水中出现气泡 水中出现气泡 ,把手松开,导气管口形成一小段水柱;b.向试管中加入CaO2,连接并固定好装置,加热; c.收集一瓶气体.能用图中所示方法收集氧气的原因是 氧气不易溶于水 氧气不易溶于水 ;d.停止加热.停止加热前应先 将导气管从水中取出 将导气管从水中取出 ;e.检验气体.检验的方法是 将带火星的小木条伸入集气瓶中 将带火星的小木条伸入集气瓶中 . |
| 实验的装置 | 实验的主要过程 |
 |
a.检查装置的气密性. b.向试管中加入CaO2和水后,有少量细小气泡缓缓放出,在导气管口几乎收集不到气体.该装置放置到第二天,集气瓶中才收集到极少量的气体,振荡试管后仍然有少量的气泡不断缓缓放出. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com