(2007?扬州)全世界每年被腐蚀损耗的钢铁材料约占全年钢铁产量的十分之一.下面是对铁的腐蚀条件及铁锈组成的探究.
问题一:探究铁生锈的条件
课本实验中,铁生锈所需要时间较长,某实验小组设计如下改进实验.
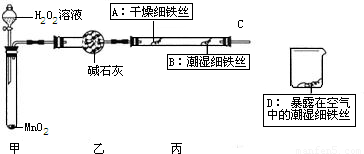
(1)检查装置的气密性:连接好装置,关闭分液漏斗的活塞,将C导管接人到装有水的烧杯中,微热甲装置,说明气密性良好的现象是______.
(2)反应开始后,甲装置中反应现象是______,MnO
2的作用______.
(3)4分钟后观察:A处铁丝依然光亮,B处铁丝表面灰暗,D处铁丝依然光亮.该实验说明铁生锈主要与______和______有关.B、D处实验现象对比说明:决定铁生锈快慢的一个重要因素是______.
问题二:测定铁锈的组成
铁锈的成分主要为Fe
2O
3?H
2O,还含有少量的FeCO
3.某兴趣小组设计如图装置测定锈铁钉的组成.取一高度腐蚀的干燥铁钉(含有少量铁),称其质量为20.08g,在N
2氛围中,充分加热到质量不再减少.该过程中仅考虑发生:Fe
2O
3?H
2O加热Fe
2O
3+H
2O,FeCO
3加热FeO+CO
2↑,且不需要考虑装置中空气对本实验的影响.(碱石灰成分:CaO和NaOH固体混合物.物质的相对分子质量:Fe
2O
3?H
2O 178,FeCO
3116)
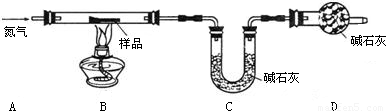
(1)若反应前后称得C装置总质量分别为100.00g和102.24g,则反应生成的CO
2和水 蒸气的总质量为______g,D装置中碱石灰的作用是______.
(2)仅有上述实验数据,无法计算组成,若在B、C之间增加一套装置即可,则装置名称和药品为______、______.
(3)经过改进后,测得m(H
2O)=1.80g,m(CO
2)=0.44g,请计算锈铁钉的组成.
①锈铁钉中Fe
2O
3?H
2O的质量═______g.
②锈铁钉中FeCO
3的质量═______g.
③锈铁钉中单质铁的质量分数═______.
(4)将20.08g该锈铁钉溶于足量的稀硫酸,充分反应后,产生的气体中是否有H
2?______(填“有”或“无”),请通过计算说明.(假设铁在H
2SO
4和Fe
2(SO
4)
3,混合溶液中先发生的反应为:
Fe+Fe
2(SO
4)
3═3FeSO
4,Fe
2(SO
4)
3的相对分子质量为400)
[计算过程].








