
分析 根据质量守恒定律可计算出二氧化碳的质量,根据化学方程式中二氧化碳和盐酸的质量比可求出碳酸钠和氯化钠的质量,进而计算出原混合物中碳酸钠的质量分数;反应后溶液的质量分数.
解答 解:由质量守恒定律可得二氧化碳的质量:11g+53.9g-60.5g=4.4g
解:(1)设原固体中碳酸钠的质量为X,生成氯化钠的质量为Y.
Na2CO3+2HCl═2NaCl+H2O+CO2↑
106 117 44
X Y 4.4g
$\frac{106}{X}$=$\frac{117}{Y}$=$\frac{44}{4.4g}$
X=10.6g Y=11.7g
原混合物中碳酸钠的质量分数$\frac{10.6g}{11g}$×100%=96.4%
(2)反应后的溶液中氯化钠的质量分数为:$\frac{11.7g+(11g-10.6g)}{60.5g}$×100%═20%
答:原混合物中碳酸钠的质量分数96.4%.
反应后的溶液中氯化钠的质量分数为20%.
点评 要想解答好这类题目,要理解和熟记根据化学反应方程式的计算步骤、格式以及与之相关的知识等,难度不大.


 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
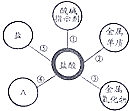 小丽在复习硫酸和盐酸的性质时归纳出,硫酸和盐酸的五条化学性质(如右图所示,连线表示相互反应).
小丽在复习硫酸和盐酸的性质时归纳出,硫酸和盐酸的五条化学性质(如右图所示,连线表示相互反应).查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 一定含有Na2CO3,一定没有NaOH Na2SO4,可能含有NaCl | |
| B. | 一定含有NaOH Na2CO3,一定没有Na2SO4,可能含有NaCl | |
| C. | 一定含有Na2CO3,一定没有Na2SO4NaCl,可能含有NaOH | |
| D. | 一定含有Na2CO3 NaCl,一定没有Na2SO4,可能含有NaOH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com