
【题目】水是生命之源,人类的生产、生活都离不开水。
(1)自然界中的水含有许多可溶性和不溶性杂质。长期饮用硬水可能会引起体内结石,生活中常用来_________区分软水与硬水,常用___________的方法来降低水的硬度。在水的净化过程中,除去水中不溶性的固体杂质,其实验操作方法称为_________。
(2)水是常用的溶剂,配制下列溶液时,以水做溶剂的是______________(填序号)。
A.食盐 B.医用碘酒 C.高锰酸钾 D.植物油
(3)右图曲线A、B、C分别代表三种固体物质的溶解度曲线,根据图示回答:
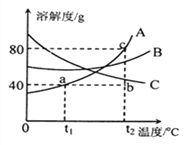
①对A物质来说,a点的意义是_____________。
②将t1℃ 140gA的饱和溶液升温至t2℃时,可用图上的______________点表示。
③若将t2℃时A、 B、C三种物质的饱和溶液降温到t1℃所得溶液质量分数由大到小的顺序是________。
④t1℃时,将30g A物质放入50g水中,充分搅拌后所得溶液的溶质质量分数为_____________。(计算结果保留一位小数)
⑤如果要获得C的晶体,采用的方法是_______(填“升温”或“降温”)。
(4)世博园区内用“活性炭+超滤膜+紫外线”组合工艺获得直饮水。其中活性炭的作用是_______;化合物X是一种新型的自来水消毒剂,工业上制取X 的化学方程式为:Cl2 + 2 NaClO2 == 2 NaCl + 2 X,则X的化学式为__________________;能够充分说明水的组成的化学反应方程式为______________________。
【答案】 肥皂水 加热煮沸 过滤 AC t1℃ 时A的溶解度是40g B C B>C>A 28.6% 升温 吸附 ClO2 2H2O![]() 2H2↑ + O2↑或2H2 + O2
2H2↑ + O2↑或2H2 + O2![]() 2H2O
2H2O
【解析】本题考查了固体溶解度曲线及其作用,硬水与软水,溶液、溶质和溶剂的相互关系与判断,溶质的质量分数、溶解性和溶解度的关系,质量守恒定律及其应用。
(1)生活中常用来肥皂水区分软水与硬水,向水中加入肥皂水搅拌,若泡沫较多,则是软水,若泡沫较少,则是软水;常用加热煮沸的方法来降低水的硬度。在水的净化过程中,除去水中不溶性的固体杂质,其实验操作方法是过滤;
(2) 水是常用的溶剂,配制下列溶液时,食盐用水做溶剂,医用碘酒用酒精做溶剂,高锰酸钾用水做溶剂,植物油不能溶于水,所以水做溶剂的是:AC;
(3)①对A物质来说,a点的意义是t1℃ 时A的溶解度是40g;
②A的溶解度随温度的升高而增大,将t1℃ 140gA的饱和溶液升温至t2℃时,溶液变成了不饱和溶液,应处于溶解度曲线下方,可用图上的BC点表示。
③将t2℃时A、B、C三种物质的饱和溶液降温到t1℃时,AB的溶解度减小,析出溶质,溶液中溶质质量减小,溶剂质量不变,溶液仍为饱和溶液,溶质的质量分数减小,C的溶解度变大,溶液中溶质、溶剂质量不变,溶质质量分数与降温前相等;饱和溶液中溶质的质量分数=![]() ×100%,即溶解度大的溶质质量分数大,t1℃时B的溶解度大于t2℃时C的溶解度大于t1℃时A的溶解度,故降温后溶质的质量分数关系为:B>C>A;
×100%,即溶解度大的溶质质量分数大,t1℃时B的溶解度大于t2℃时C的溶解度大于t1℃时A的溶解度,故降温后溶质的质量分数关系为:B>C>A;
④t1℃时A的溶解度是40g,即100g水中最多溶解40g的a,所以将30g A物质放入50g水中,充分搅拌后最多溶解20g,故所得溶液的溶质质量分数为![]() ×100%≈28.6%;
×100%≈28.6%;
⑤C的溶解度随温度的升高而减小,如果要获得C的晶体,采用的方法是升温。
(4)根据制取X的化学方程式为:Cl2+2NaClO2═2NaCl+2X,反应物中有4个氯原子,2个钠原子,4个氧原子,生成物中有2个钠原子,2个氯原子,所以X的化学式为ClO2;水的通电分解生成氧气和氢气,氢气在氧气燃烧生成水,都能说明水的组成,化学反应方程式分别为:2H2O![]() 2H2↑ + O2↑、2H2 + O2
2H2↑ + O2↑、2H2 + O2![]() 2H2O。
2H2O。


 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案科目:初中化学 来源: 题型:
【题目】用如下图装置测定空气中氧气的含量,下列说法正确的是

A. 点燃白磷后,慢慢将燃烧匙插入瓶中,塞紧瓶塞
B. 用细铁丝代替白磷进行实验,不会影响实验结果
C. 不打开瓶塞,聚焦太阳光引燃足量白磷,实验效果更好
D. 若实验过程中,没有将弹簧夹夹紧,不会影响实验结果
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下图是家用豆浆机,请根据图回答下列问题:

(1)制作材料中属于金属或合金的是 ______ (选填一种 物质编号),
(2)合金与组成它的纯金属相比,硬度 ______、熔点______。
(3)属于单质的是 ______ (选填一种物质编号)
(4)传统的生豆浆是用石磨来打磨的,打磨的过程是 ______变化 ;
(5)用操作将黄豆渣分离的方法类似于我们实验中的 ______ 操作.
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】五氧化二钒(V2O5)是一种工业催化剂,下图是生产V2O5的工业流程,下列说法正确的是
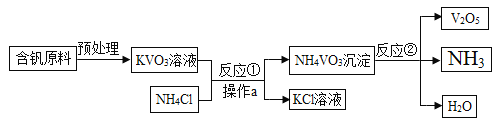
A. NH3能使干燥的红色石蕊试纸变蓝
B. 反应①中生成的副产物KCl在农业上可用作钾肥
C. 反应②的化学方程式为2NH4VO3![]() V2O5+2NH3↑+H2O
V2O5+2NH3↑+H2O
D. 操作a中需要的所有仪器为铁架台、烧杯、滤纸、玻璃棒
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】在实验室里称量一定质量的Na2CO3放入烧杯中,加入一定质量分数的稀硫酸100 g,恰好完全反应,共生成2.2 g的CO2气体(假设产生的气体完全逸出,水的挥发忽略不计)。已知实验中发生的化学反应:Na2CO3+H2SO4=Na2SO4+CO2↑+H2O
(1)Na2CO3样品的质量为_________________g。
(2)100 g稀硫酸的溶质质量分数为_______________(写出计算过程)。
(3)反应后烧杯中溶液的溶质质量分数为______________(写出计算过程,结果精确到0.1%)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】小明选择“铝丝和盐酸反应的快慢与什么因素有关”的课题开展探究。下表是他分别用相同质量的铝丝和足量稀盐酸反应的三组实验数据:
实验编号 | 盐酸的浓度/% | 反应温度/℃ | 铝丝消失 的时间/s |
① | 3 | 20 | 500 |
② | 6 | 20 | 300 |
③ | 6 | 30 | 80 |
(1)写出铝和盐酸反应的化学方程式:________________________________。
(2)实验②和③表明:该反应的快慢与__________有关。
(3)能表明盐酸浓度对反应快慢有影响的实验编号是________和________。
(4)如果把实验①中盐酸的浓度改为4%,请你推出铝丝消失的时间(用t表示)的取值范围:________________。
(5)该实验除了用铝丝消失的时间来衡量反应的快慢外,你还能提出新的方法来衡量该反应的快慢吗?
方法:_____________________________________________________________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图化学反应的溶液颜色变化体现了“魔法世界,魅力化学”,请回答:

(1)溶液X是 (填“酸”、“碱”、“盐”),试剂A的名称是 .
(2)若X是稀硫酸,B是氧化物,则B的化学式为 .
(3)若X是稀盐酸,C是单质,则C的名称是 .
(4)若X是稀硫酸,D是碱,则X与D反应的化学方程式为 .
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】已知20 ℃时,在100 g水中达到饱和所能溶解的KNO3的最大量是31.6 g。向50 mL水(密度是1 g/mL)中溶解一定量KNO3固体如下。请回答:
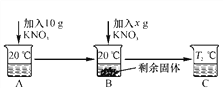
(1)A、B、C中一定是饱和溶液的是________(填字母)。
(2)当x=________g时,B中恰好没有固体剩余。
(3)硝酸钾晶体从溶液中析出常用______________的方法。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如下图(夹持仪器已略),某兴趣小组在老师指导下,探究铁与水蒸气的反应,请回答。
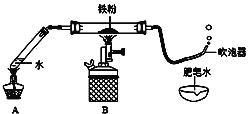
【实验初探】
(1)连接装置,并___________。
(2)装好药品。
(3)加热一段时间后,吹泡器连续吹出气泡,且气泡向上飞起,用燃着的木条靠近气泡,能产生爆鸣。
该气体燃烧的化学方程式为________。
【查阅资料】铁有三种氧化物(FeO、Fe2O3、Fe3O4)。
①它们都不溶于水,其中铁粉、Fe3O4能被磁铁吸引;②FeO接触到空气会立即由黑色变为红棕色;③三种氧化物都不与硫酸铜溶液反应,但能与酸反应生成可溶性物质。
【实验探究】实验小组同学对反应后的剩余固体进行探究。
(1)小梅发现固体为黑色,由此判断:固体中肯定不存在Fe2O3 ,理由是_______。
(2)小宇发现固体均能被磁铁吸引,大家倒出玻璃管中黑色固体,平铺于白纸上。观察现象是__________,判断黑色固体中一定没有FeO。
讨论:铁与水蒸气反应生成的固体是“铁的一种氧化物”,玻璃管内的黑色固体中还可能含有“过量的铁”。
【提出猜想】玻璃管中黑色固体成分有什么?
猜想Ⅰ:Fe; 猜想Ⅱ:Fe3O4; 猜想Ⅲ:______________
实验步骤 | 实验现象 | 实验结论 |
取上述固体少许,加入足量 _________________ | 出现红色固体,且有黑色固体残留 | 黑色固体中一定含有 ________________ |
【结论反思】(1)铁与水蒸气发生置换反应,反应的方程式是________________。
(2)出现红色固体的化学方程式是_______,加入的溶液必须足量的原因是______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com