
| 反应时间(秒) | 0 | 25 | 50 | 75 | 100 | 125 | 150 | 175 | 200 |
| 滴入稀盐酸体积(毫升) | 0 | 4 | 8 | 12 | 16 | 20 | 24 | 28 | 32 |
| pH | 13.2 | 13.0 | 12.7 | 12.4 | 12.1 | 7.0 | 2.0 | 1.6 | 1.3 |
| 温度(℃) | 36.9 | 37.5 | 38.0 | 38.5 | 38.8 | 39.2 | 39.0 | 38.8 | 38.6 |
分析 (1)根据pH值来确定酸碱性;
(2)根据中和反应是放热反应进行分析;
(3)当pH=7时,两者恰好完全反应,根据溶质的质量分数的计算公式可求出HCl的质量;然后利用化学方程式的计算可求出参加反应的氢氧化钠的质量.
解答 解:(1)我们发现溶液的pH由>7变为<7溶液由碱性变为酸性,当pH=7时,氢氧化钠与盐酸恰好中和,此时反应进行到125秒时;
(2)由于中和反应是放热反应,随盐酸量增加,中和反应放出热量增大,溶液温度上升;过量盐酸起冷却降温作用,反应停止热量散失,所以温度又会下降;
(3)我们发现当恰好反应时,用去盐酸的体积为20mL.
HCl的质量=20mL×l.0g/mL×0.73%=0.146g
设参加反应的氢氧化钠质量为x
NaOH+HCl=NaCl+H2O
40 36.5
x 0.146g
$\frac{40}{x}$=$\frac{36.5}{0.146g}$
x=0.16g
答:氢氧化钠稀溶液中溶质的质量为0.16g.
故答案为:(1)125;
(2)中和反应是放热反应,随盐酸量增加,中和反应放出热量增大,溶液温度上升;过量盐酸起冷却降温作用,反应停止热量散失,所以温度又会下降;
(3)0.16g.
点评 主要考查了中和反应的实质及反应过程中伴随的现象,培养学生分析问题、应用知识的能力.


科目:初中化学 来源: 题型:选择题
| A. | 研制和开发洁净能源,防治空气污染 | |
| B. | 减少二氧化碳的排放,预防温室效应 | |
| C. | 开展村庄生活污水排放治理,保护水资源 | |
| D. | 实行限塑令,解决白色污染问题 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:多选题
| A. | 1.1g 5.55g | B. | 2.2g 5.55g | C. | 3.3g 11.1g | D. | 4.4g 11.1g |
查看答案和解析>>
科目:初中化学 来源: 题型:推断题
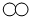 ”和“
”和“ ”分别代表两种不同的单质的分子A2和B2,它们在一定条件下能发生化学反应,其反应的微观示意图如图:
”分别代表两种不同的单质的分子A2和B2,它们在一定条件下能发生化学反应,其反应的微观示意图如图: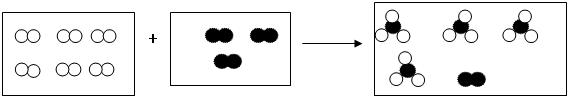
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 将光亮的铜丝插入稀盐酸中,有气泡产生 | |
| B. | 硫在空气中燃烧,发出明亮的蓝紫色火焰,生成无色无味的气体 | |
| C. | 铁丝在空气中点燃,剧烈燃烧,火星四射,生成黑色固体 | |
| D. | 将人体呼出的气体导入紫色石蕊试液,试液变成红色 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 火的发现和利用 | |
| B. | 原子论和分子学说的创立 | |
| C. | 门捷列夫发现元素周期表 | |
| D. | 发现和合成的新物质已超过7000万种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com