
����Ŀ������Cu2O����������Ĵ����ܱ��ܹ�ע��ij��ȤС��ͬѧ�ڡ�������ѧ��������ѧ�����Ļ�ѧʵ���ѧ�о�����������ʦ�Ĵ����¿�չ��ϵ���о��� ������Cu2O����;�о�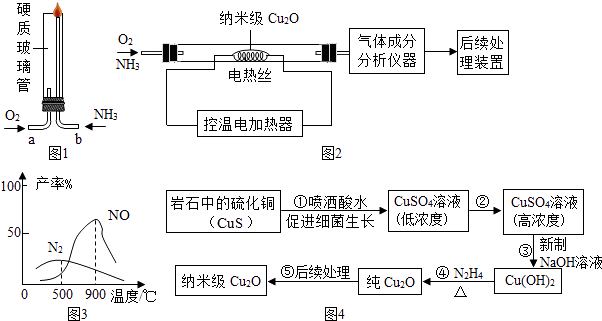
���������ϡ�
�ٰ�����һ���д̼�����ζ�����壬�ڸ�Ũ�������в���ȼ�գ����ɵ�����ˮ��
��������Cu2O�Ĵ������£�������������һ���¶��·������»�ѧ��Ӧ��
4NH3+5O2�T4NO+6H2O 4NH3+3O2�T2N2+6H2O
��ҵ����NO�Ʊ����ᡢ���ʵȻ�����Ʒ��
��1����ʵ��1�� ���ͼ1��ʵ��װ����֤������������ȼ�գ��������������백���ֱ��a��b���ܽ�����ͨ�룬����b���϶˵�ȼ������ʵ��������ͨ����������ͨ�백���������� ��
��ʵ��2�������ͼ2ʵ��װ�ã�������������гɷַ���
��������ɷַ������ݣ�ͬѧ�ǻ���������ͼ����ͼ3��������������
Cu2O�Ĵ������£�300��ʱ������Ϊ���������ú�������װ��
ģ������Ĺ�ҵ�Ʒ�����ý�����˿���¶ȿ����������ң�
������Cu2O���Ʊ��о�
����ijЩ�����ϸ������һ�������½�ij��ʯ�еIJ�������ͭ��CuS��ת��Ϊ��������ͭ�������Ƶ�����Cu2O����������ͼ4��
��ϸ�������£���ʯ�е���ͭ��CuS��������е�������Ӧ��������ͭ����Ӧ�Ļ�ѧ����ʽΪ ��
��2�����й۲쵽�������� ��
��3���ڼ��������£���Һ̬�£�N2H4����ԭ����Cu��OH��2����Cu2O��N2��H2O����Ӧ�Ļ�ѧ����ʽΪ �� Cu2O��ͭԪ�صĻ��ϼ��� ��
��4�����ⶨ����ʯ����ͭ��CuS������������ͭԪ�ص�������ɣ�����1000g����ʯ�Ƶ�21.6g��������ͭ��Cu2O�����ô�������ͭ��Cu2O����ͭԪ�ص�������g�����Ƶ�������ͭ��Cu2O���Ĺ����У�ͭԪ�ص������Ϊ25%��ͨ������ȷ������ʯ����ͭ��CuS����������������д��������̣���
���𰸡�
��1��NH3��ȼ����Ҫ��Ũ����������ͨ�������Ա�֤��������ȼ��������900��CuS+2O2 ![]() CuSO4
CuSO4
��2��������ɫ����
��3��N2H4+4Cu��OH��2 ![]() 2Cu2O+N2��+6H2O��+1
2Cu2O+N2��+6H2O��+1
��4��19.2��Cu2O��ͭԪ������Ϊ21.6g�� ![]() =19.2g���Ƶ�������ͭ��Cu2O���Ĺ����У�ͭԪ�ص������Ϊ25%������CuS��ͭԪ������Ϊ
=19.2g���Ƶ�������ͭ��Cu2O���Ĺ����У�ͭԪ�ص������Ϊ25%������CuS��ͭԪ������Ϊ ![]() =25.6g�����CuS������Ϊ
=25.6g�����CuS������Ϊ ![]() =38.4g���ʸ���ʯ��CuS����������Ϊ
=38.4g���ʸ���ʯ��CuS����������Ϊ ![]() =3.84%
=3.84%
���������⣺��1����ʵ��1��NH3��ȼ����Ҫ��Ũ����������ͨ�������Ա�֤��������ȼ����ʵ��2����ͼ���߿��Կ�������300��ʱ������NO�����ߣ��Ե���Ϊ���������ú�������װ��ģ������Ĺ�ҵ�Ʒ�����������Ӧ��NOΪ���������ý�����˿���¶ȿ�����900�����ң���Ӧ������ͭ��CuS��������е�������������������ͭ����Ӧ������ϸ������ѧ����ʽΪCuS+2O2 ![]() CuSO4����2�����з�Ӧ������ͭ��Һ�м����������ƣ�����������������ͭ����˿ɹ۲쵽������ɫ��������3����Ӧ����Һ̬�£�N2H4����Cu��OH��2����������Cu2O��N2��H2O����Ӧ�Ļ�ѧ����ʽΪN2H4+4Cu��OH��2
CuSO4����2�����з�Ӧ������ͭ��Һ�м����������ƣ�����������������ͭ����˿ɹ۲쵽������ɫ��������3����Ӧ����Һ̬�£�N2H4����Cu��OH��2����������Cu2O��N2��H2O����Ӧ�Ļ�ѧ����ʽΪN2H4+4Cu��OH��2 ![]() 2Cu2O+N2��+6H2O��Cu2O����Ԫ��Ϊ��2�ۣ����ݻ��������������ϼ۴�����Ϊ0��֪ͭԪ�ػ��ϼ�Ϊ+1�ۣ���4���� ���Դ��ǣ���1����ʵ��1��NH3��ȼ����Ҫ��Ũ����������ͨ�������Ա�֤��������ȼ��
2Cu2O+N2��+6H2O��Cu2O����Ԫ��Ϊ��2�ۣ����ݻ��������������ϼ۴�����Ϊ0��֪ͭԪ�ػ��ϼ�Ϊ+1�ۣ���4���� ���Դ��ǣ���1����ʵ��1��NH3��ȼ����Ҫ��Ũ����������ͨ�������Ա�֤��������ȼ��
��ʵ��2��������900�� CuS+2O2 ![]() CuSO4����2��������ɫ��������3��N2H4+4Cu��OH��2
CuSO4����2��������ɫ��������3��N2H4+4Cu��OH��2 ![]() 2Cu2O+N2��+6H2O��+1����4��19.2��3.84%��
2Cu2O+N2��+6H2O��+1����4��19.2��3.84%��
�����㾫����������Ĺؼ�����������д��ѧ����ʽ�����ֱ���ʽ�����뷽��ʽ�����֪ʶ������ע�⣺a����ƽ b������ c�����ţ��Լ��Ը��ݻ�ѧ��Ӧ����ʽ�ļ�������⣬�˽�����ʼ�������=ϵ������Է�������֮�ȣ�


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ú��ʯ�ͺ���Ȼ���Ȼ�ʯȼ����Ŀǰ����ʹ�õ�����Ҫȼ�ϣ�Ҳ����Ҫ�Ļ���ԭ�ϣ�
��1��ʯ������Ҫ��������Ԫ�أ���дԪ�ط��ţ�����Ȼ������Ҫ�ɷ�������д��ѧʽ����
��2����ʯȼ��������ѡ�����������������������Դ����ȼ���ŷŵĴ���������̼������ȫ�������ů��һ���µĴ��������ǽ�������̼����ͨ�뺬�г�ʯ���ؿ�������Ŀ�ʯ�������ߴ�60%���ɷֵ�ˮ��Һ�����һ�ַ�Ӧ�Ļ�ѧ����ʽ�� KAlSi3O8+CO2+2H2O�TKHCO3+X+3SiO2������X�Ļ�ѧʽΪ ��
��3����ҵ�ϣ�ú̿ȼ��ǰ���з����Ŀ���� �� ú����������ǿ�ȵõ��Ľ�̿����ұ������Ҫԭ�ϣ�Ϊ�˲ⶨij����������������������������ѧ��ȤС���ͬѧ���������ʵ�鷽��������ó������е����ʼȲ�����ˮ��Ҳ��������Ӧ���� ����I ȡ8.00g������ۣ���������ϡ���ᣬ��ȫ��Ӧ����ˣ��õ�1.60g��������������������������������Ϊ ��
��������ͼ��ʾ��ȡ8.00g�������������Ľ�̿�ۻ�Ϻ��ǿ�ȣ���ַ�Ӧ���������������Һ��Ӧǰ������������1.32g����������Ķ�����̼������������Һ��ȫ���գ�������ѧ��Ӧ3C+2Fe2O3 ![]() 4Fe+3CO2���㣬�������������������������Ϊ ��
4Fe+3CO2���㣬�������������������������Ϊ ��
��4����ʵ�鷴˼����������Ӳ�ʲ�������ԭ�еĿ�����ʵ������Ӱ�죬��ᵼ�²����������������������ѡ�ƫ����ƫС�����䡱���� ��ʵ�����������I������������������������Դ��ڷ��������Ľ�������ܵ�ԭ������д��һ�ּ��ɣ���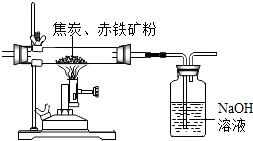
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ݴ��������������ʵ�ȥ������Һ������ʵ��ͼʾ�ش�������⣺ 
��1�����������������������
��2�������բڢۢٲ�������50g 16%��NaCl��Һ����������Һ�����������������ƫ����ƫС������Ӱ�족����
��3����������ֹͣ������ʱ����������ţ���
A.��������Һ����ȫ����ʱ
B.���������д�����������ʱ
��4����ȥ�����������Ե����ʲ����㾫�εIJ��ʣ�����ȷ��������Ϊ�ڢۢ٢ܢݢڣ����²����п��ܻᵼ�¾��β��ʣ�����= ![]() ��100%��ƫС����������ţ���
��100%��ƫС����������ţ���
A.����������������Һ�����ձ�
B.�����������Ӷ���
C.��������Һ�������ֽ��Ե
D.��������û��ʹ�ò��������裮
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ϡ�����ϡ��������������ƻ�ѧ���ʵ�ԭ���ǣ� ��
A�����Ƕ�����Һ B�����Ƕ������������
C�����Ƕ�������Ԫ�� D�����Ƕ��������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ�Ͻ�������������Cl2���ڵ�ȼ�������·�Ӧ�����Ȼ��⣨HCl������ˮ�����Ȼ��������ᣮ������������ȼ�յĻ�ѧ����ʽΪ �� ��Ӧ�Ļ��������� �� ����з�̪������������Һ�еμ�ϡ���ᣮ��Һ�ɺ�ɫ�����ɫ���÷�Ӧ�Ļ�ѧ����ʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ʹ�ø�������������IJ��������У��Ⱥ�˳�淶����
A���ȼ��װ�õ������ԣ��ټ���ҩƷ
B���ȴ�ˮ�����ó�����ƿ���������ϣ��ٸ��ϲ���Ƭ
C�����������ʱ�����ðѵ���һ�˽���ˮ�У���˫�ֽ����Թ����
D�����Թ��е�ҩƷ����ʱ����Ԥ�ȣ��ٶ����Թ���ҩƷ��λ���м���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ȼ�李�����李�����狀����ض��ǰ�ɫ���壬Ҳ����Ҫ�Ļ��ʡ����������ܹ������ش������ֻ����м����������( )
A. �Ȼ��� B. ϡ���� C. �������� D. ˮ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��������ʯ��ʯ�ͷ�ͭм���������ʯ�ࡢ������Һ�Ĺ���������ͼ�� 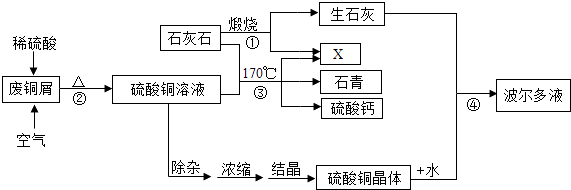
��1��X�Ļ�ѧʽΪ ��
��2����Ӧ���п����������� ��
��3��ʯ��Ļ�ѧʽΪ2CuCO3Cu��OH��2 �� д����Ӧ�۵Ļ�ѧ����ʽ ��
��4������Ӧ��������ͭ����ʯ�Һ�ˮ�Ļ�ѧ������֮��Ϊ1��1��1�����仯ѧ����ʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������к��������һ�ѧ���ʲ����õ�������
A������ B������ C��������̼ D��ϡ������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com