
����Ŀ��ͭ����������ʹ�����硢Ӧ�ù㷺�Ľ�����
(һ)�ԹŴ���Ʒ����ʶ
��ͭ������˿��֯Ʒ���մ��������ҹ��Ŵ��Ͷ�������ĻԻͳɾͣ�
(1)������Ʒ���漰���IJ�����______(ѡ�����)��
A���������� B�����ǽ������� C�����ϲ���
(2)��ͼ1Ϊ��������Ŵ���ͭ��������̤���������������ܱ��������ԭ�������_____(ѡ�����)��
A��ͭ�Ļ������� B��ͭ�������� C�������ڵ��£���������
(��)����ͭ��ұ��
���ҹ��Ŵ����ÿ�ȸʯ��ͭ���漰��Ҫ��Ӧ�Ļ�ѧ����ʽ��_________��2CuO+C![]() 2Cu+CO2����
2Cu+CO2����
������ͭ��ʯ�г�����(Fe2O3)��������(Fe3O4)��������(FeS2)����ͭ��(CuFeS2)�ȣ�CuFeS2Ϊ��������ͭ������SԪ�صĻ��ϼ�Ϊ______��
(1)��ҵ���������ó����������Դ�����Ϊԭ��������Ӧ�Ļ�ѧ����ʽΪ______________��
���������û�����ͭ���ܵ�ԭ���ǣ�
�ٻ�����ͭ��������Եͣ���________________________________��
(2)�Ի�ͭ��Ϊԭ�ϣ�����������ͭ���ִ���ͭ���¹��գ�ԭ��Ϊ��4CuFeS2+17O2+2H2SO4![]() 4CuSO4+2Fe2(SO4)3+2H2O��
4CuSO4+2Fe2(SO4)3+2H2O��
��������Ӧ�����Һ�м���Fe�ۣ��õ�FeSO4��Һ��Cu��
�ٷ�����Ҫ��Ӧ�Ļ�ѧ����ʽ��Fe+Fe2(SO4)3=3FeSO4��________________________��
��FeSO4��Һ������Ũ����___________�����˵Ȳ����õ�FeSO47H2O���壮
(��)��ͭ��������ͭ�����IJⶨ
�ڿ�����Աָ���£���ȤС���ȡ25.00g��ͭ��(������Fe2O3��������������Ԫ�ص�����)ģ��������ͭ��ʹ��ȫ��ת��ΪCuSO4��Fe2(SO4)3��Һ������Һ�м������NaOH��Һ�õ�Cu(OH)2��Fe(OH)3���壮
(1)֤��NaOH��Һ�����ķ��������ã����ϲ���Һ�еμ�________��Һ��������
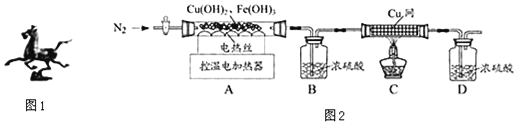
(2)��ͼ2װ�öԹ�������ȷֽ�ʵ�飮
�����ϡ�
����68��ʱ��Cu(OH)2�ֽ�ΪCuO����500��ʱ��Fe(OH)3�ֽ�ΪFe2O3��
����1400��ʱ��CuO�ֽ�ΪCu2O��O2��Fe2O3�ֽ�Ϊ���ӵ������������O2��
(1)װ���ʵ��װ�ú���Ҫ________________��
(2)ֹͣ���Ⱥ��������ͨN2���ɷ�ֹ������______________________________��
(3)���Ʋ�ͬ���¶ȶ�A�й�����ȣ����װ��B��C��ͭ���������仯�����
�¶�/�� | ���� | 100 | 550 | 1400 |
Bװ��/g | 200.00 | 201.80 | 205.04 | 205.04 |
C��ͭ��/g | 100.00 | 100.00 | 100.00 | 101.28 |
�ٴ˻�ͭ����ͭ����Ԫ�ص�������������(Cu)%=________����(Fe)%=__________��
�ڸ��ӵ����������ﻯѧʽΪ__________��
���𰸡� C AC Cu2(OH)2CO3![]() H2O+CO2��+2CuO ��2 Fe3O4+4CO
H2O+CO2��+2CuO ��2 Fe3O4+4CO![]() 3Fe+4CO2 ұ�������л�����ж��������������Ⱦ���� Fe+CuSO4=Cu+FeSO4 ���½ᾧ NaOH ���װ�õ������� ʹ���ɵ�����ȫ����B��Cװ������ 25.60% 26.88% Fe4O5
3Fe+4CO2 ұ�������л�����ж��������������Ⱦ���� Fe+CuSO4=Cu+FeSO4 ���½ᾧ NaOH ���װ�õ������� ʹ���ɵ�����ȫ����B��Cװ������ 25.60% 26.88% Fe4O5
����������һ����1����ͭ�ǺϽ����ڽ������ϣ�˿��������Ȼ���ϣ��մ��������ǽ������ϣ���2��ͭ�Ļ�������������ڵ��¸����˿�����������ͭ���������⣻�������ټ�ʽ̼��ͭ���ȷֽ���������ͭ��������̼��ˮ����Ӧ�Ļ�ѧ����ʽΪ��Cu2(OH)2CO3![]() H2O+CO2��+2CuO����CuFeS2Ϊ��������ͭ������ͭԪ����+2�ۣ���Ԫ����+2�ۣ�����Ԫ�صĻ��ϼ�Ϊx����+2��+��+2��+2x=0��x=-2��(1)��ҵ����CO�ʹ�������������Ҫ������CO�Ļ�ԭ�ԣ��ڸ����º���������Ӧ�������Ͷ�����̼����Ӧ�Ļ�ѧ����ʽΪFe3O4+4CO
H2O+CO2��+2CuO����CuFeS2Ϊ��������ͭ������ͭԪ����+2�ۣ���Ԫ����+2�ۣ�����Ԫ�صĻ��ϼ�Ϊx����+2��+��+2��+2x=0��x=-2��(1)��ҵ����CO�ʹ�������������Ҫ������CO�Ļ�ԭ�ԣ��ڸ����º���������Ӧ�������Ͷ�����̼����Ӧ�Ļ�ѧ����ʽΪFe3O4+4CO![]() 3Fe+4CO2���ڻ�����ͭ�������ͣ����жԻ����к���Ԫ��������ұ�������л�����ж��������������Ⱦ��������˻�����ͭ����������(2)�ټ����������������ͭ��Ӧ����ͭ��������������Ӧ�Ļ�ѧ����ʽ�� Fe+CuSO4=Cu+FeSO4����FeSO4��Һ������Ũ�������½ᾧ�����˵Ȳ����õ�FeSO47H2O���壻������(1)�������ϲ���Һ�еμ�����������Һ���������������������Ƶ������㣬��û�г������������������Ѿ������������ϡ�(1)�������������ɵķ�Ӧ����ʵ��ǰ��һ��Ҫ���װ�õ������ԣ� (2)Ϊ��ʹ������ˮ��������������ȫ���գ�����ֹͣ���Ⱥ��������ͨN2��ʹ���ɵ�����ȫ����B��Cװ�����գ�(3)��������ͭԪ�ص�����Ϊx��������ͭ���Ȼ�ֽ�Ϊ����ͭ��ˮ������ʽΪCu��OH��2
3Fe+4CO2���ڻ�����ͭ�������ͣ����жԻ����к���Ԫ��������ұ�������л�����ж��������������Ⱦ��������˻�����ͭ����������(2)�ټ����������������ͭ��Ӧ����ͭ��������������Ӧ�Ļ�ѧ����ʽ�� Fe+CuSO4=Cu+FeSO4����FeSO4��Һ������Ũ�������½ᾧ�����˵Ȳ����õ�FeSO47H2O���壻������(1)�������ϲ���Һ�еμ�����������Һ���������������������Ƶ������㣬��û�г������������������Ѿ������������ϡ�(1)�������������ɵķ�Ӧ����ʵ��ǰ��һ��Ҫ���װ�õ������ԣ� (2)Ϊ��ʹ������ˮ��������������ȫ���գ�����ֹͣ���Ⱥ��������ͨN2��ʹ���ɵ�����ȫ����B��Cװ�����գ�(3)��������ͭԪ�ص�����Ϊx��������ͭ���Ȼ�ֽ�Ϊ����ͭ��ˮ������ʽΪCu��OH��2 ![]() CuO+H2O�������¼��ȵ�100��ʱ��װ��B�����ص�����Ϊ������ͭ�ֽ�����ˮ������λx���������Ϣ��֪������һϵ�л�ѧ��Ӧʱ�����ʵĹ�ϵ�ǣ�
CuO+H2O�������¼��ȵ�100��ʱ��װ��B�����ص�����Ϊ������ͭ�ֽ�����ˮ������λx���������Ϣ��֪������һϵ�л�ѧ��Ӧʱ�����ʵĹ�ϵ�ǣ�
Cu��CuFeS2��CuSO4��Cu��OH��2��H2O
64 18
x ��201.80-200.00��g
![]()
x=6.4g��
��˻�ͭ����ͭԪ�ص���������������Cu��%=![]() ��100%��25.60%��
��100%��25.60%��
��������Ԫ�ص�����Ϊy�������������Ȼ�ֽ�Ϊ��������ˮ������ʽΪ2Fe��OH��3 ![]() Fe2O3+3H2O����100����ȵ�550��ʱ��װ��B�����ص�����Ϊ���������ֽ�����ˮ���������������Ϣ��֪������һϵ�л�ѧ��Ӧʱ�����ʵĹ�ϵ�ǣ�
Fe2O3+3H2O����100����ȵ�550��ʱ��װ��B�����ص�����Ϊ���������ֽ�����ˮ���������������Ϣ��֪������һϵ�л�ѧ��Ӧʱ�����ʵĹ�ϵ�ǣ�
2Fe��2CuFeS2��Fe2��SO4��3��Fe��OH��3��3H2O
112 54
y ��205.04-201.80��g
![]()
y=6.72g
��˻�ͭ������Ԫ�ص���������������Fe��%=![]() ��100%��26.88%��
��100%��26.88%��
������ͭ���ȷֽ�ķ���ʽΪ��4CuO![]() Cu2O+O2��
Cu2O+O2��
������ͭ�ֽ���������������Ϊz����
4Cu��4CuO��2Cu2O��O
256 32
6.4g z
![]()
z=0.8g��
��Ϊװ��C���ص�����Ϊ����ͭ���������ֽ�����������������������������ֽ���������������Ϊ����101.28g-100.00g-0.8g��=0.48g��������������Ϊ��6.72g��112160��100%=9.6g��
���ɵĸ��������������к���Ԫ�ص�����Ϊ��9.6g-0.48g-6.72g=2.4g��
���ӵ���������������ԭ������ԭ�ӵĸ�����Ϊ��6.72g56��2.4g16=4��5��
���ӵ����������ﻯѧʽΪ��Fe4O5��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ�ⶨij���Ͻ���Ʒ(�����⣬����ɷֲ�����ˮ���Ҳ������κη�Ӧ)�е������ĺ�����С��ͬѧ����ʵ�����£�

��ش��������⣺
(1)����ʵ������з�����Ӧ�Ļ�ѧ����ʽΪ_____��
(2)��Ʒ�е���������������Ϊ_____��
(3)������֪�����г��������ϡ��������������(x)�ı���ʽΪ_____��
(4)�������õ��IJ�������Һ�����ʵ���������Ϊ_____��
(5)���ú�������80%�ij�������������ʵ��������Ҫ�����Ͻ�160t������������Ҫ�����������Ϊ_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ�����������ߣ�������¡�ʳ��ס���ж��벻����ѧ��
(1)�ڳ������̲������ѧ֪ʶ��
������ʳ���У����ṩ����ά���ص���________________(����ĸ)��
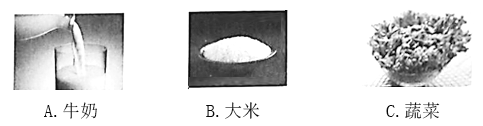
�ڼ��������е���������ָ______(����Ԫ��������ԭ����), ����ȱ��������ƶѪ��
�۳�������������ˮ����������____________��
��Ϊ��ֹ�˵����⣬�ɲ��õ�һ�ִ�ʩ��__________��
(2)�������������ɻ����ѳ�Ϊ���dz��еij��ý�ͨ���ߡ�
���������������õ�һ��ȼ�ϡ���ʯ�ͼ��ȣ����ø��ɷֵķе㲻ͬ�����Ƿ���ɵõ����ͣ��ù�������______�仯��������Ǧ���ع���ʱ���������»�ѧ��Ӧ��Pb+bO2+2H2SO4=2PbSO4+2H2O�÷�Ӧ�漰���������������������__________��
�ڸ�����ͷ�IJ�����������������֬�����ϵ�ճ�϶��ɣ�������ǿ���ײ���������ֲ�������___________(����ĸ)��
A�����ϲ��� B���ϳɲ��� C������������
������ɻ�ʹ����Ӳ��(��ͭþ��Ͻ�)������þԪ�ص�ij�����ӽṹʾ��ͼΪ![]() ��þԭ�ӵ�������������___________��
��þԭ�ӵ�������������___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼΪA��B��C�������ʵ��ܽ�����ߣ��Իش�
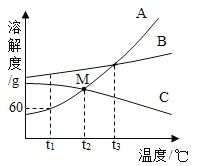
(1)t1��ʱA��B��C�������ʵ��ܽ�ȴ�С��ϵ��________����
(2)M������___________��
(3)t1��ʱ��40gA���ʼ��뵽50gˮ�г�ֽ��裬�γ���Һ����������������___________��
(4)��t3��ʱA��B��C�������ʵı�����Һ���µ�t1�棬������Һ����������������С��ϵ��______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��Cu2O+H2SO4�TCu+CuSO4+H2O��16.0g CuO��CO��Ӧ�õ�Cu��Cu2O�����13.6g�����˻��������������100.0gϡH2SO4��9.6gCu������˵����ȷ����(����)
A. ����2.4g CO2
B. ������к�9.6gͭԪ��
C. �������Cu��Cu2O������֮��Ϊ8��9
D. ��Ӧ����Һ��CuSO4����������ԼΪ7.0%
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���û�ѧ���ű�ʾ��
(1)������ԭ�� _____
(2)3���ȷ��� _____
(3)��������� _____
(4)+2�۵�þԪ�� _____
(5)������ _____
(6)�Ȼ����� _____
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ҽ����������ɵĻ�����(��Ҫ�ɷ���FeS2)��������H2SO4����Ҫԭ�ϣ����û���������H2SO4�ĵ�һ����ӦΪ��4FeS2+11O2�T2Fe2O3+8X�����ò���Fe2O3��ұ��������Ҫԭ�ϣ��ش��������⣺
(1)��֪FeS2��Fe�Ļ��ϼ�Ϊ+2����S�Ļ��ϼ�Ϊ________��
(2)X�Ļ�ѧʽ��_________��
(3)д����¯��Fe2O3ת�������Ļ�ѧ����ʽ__________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪�ڳ�����AΪҺ�壬B��C��F�����壻 ����C����������壬F���������ЧӦ����Ҫ���壻GΪ��ɫ���嵥�ʣ�H�ǰ�ɫ������ˮ�Ĺ��壬����֮���ת���ϵ��ͼ����ش��������⣺
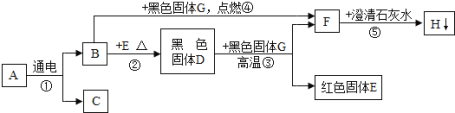
��1��д���й����ʵĻ�ѧʽ��C�� ��G�� ��H�� ��
��2��д����Ӧ���Ļ�ѧ����ʽ ���÷�Ӧ�Ļ�����Ӧ������ ��
��3��д����Ӧ���Ļ�ѧ����ʽ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й۵���������غ㶨�ɵ���
A��ij�����ڿ�����ȼ��ֻ����CO2��H2O���������һ������̼���⡢��Ԫ��
B��һ�������£�CO��O2����CO2����Ӧǰ�������������
C��1gH2��1g O2��ȫ��Ӧ������2g H2O
D��ʯ��ʯ���������ᷴӦ���������������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com