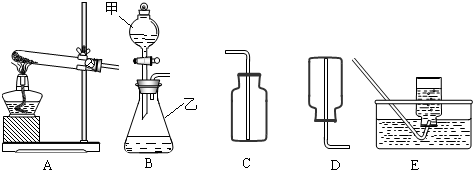
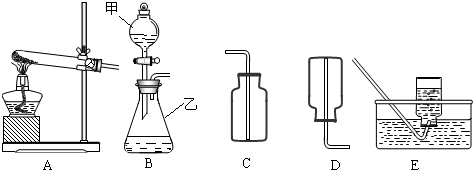
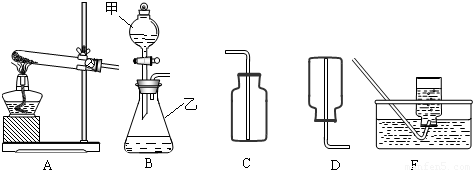
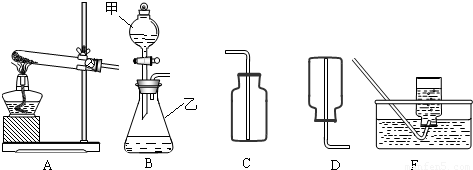
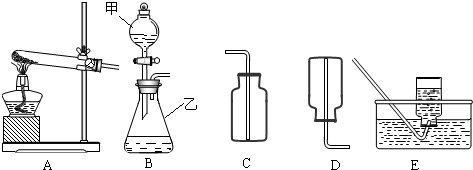
解:(1)有题目中的图形可知,甲:分液漏斗;乙:锥形瓶;
(2)在B装置导管处装上橡胶管,并用止水夹夹上后,从甲向乙中注入一定量的水,静止后如图所示,则B装置不漏气;
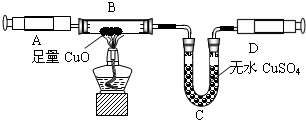
(3)如果实验室用A、E组合来制取并收集氧气,如果加一小团棉花,则一定为高锰酸钾加热制取氧气,故化学方程式为:2KMnO
4
K
2MnO
4+MnO
2+O
2↑;先移导管后熄灯,防止水倒流,引起试管炸裂.
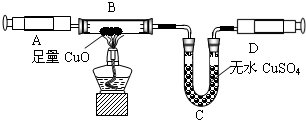
(4)①由题意,“实验室常用加热氯化铵固体和氢氧化钙固体的混合物来制取氨气”,可知反应物为:氯化铵固体和氢氧化钙,符合复分解反应特征,故化学方程式为:2NH
4Cl+Ca(OH)
2
2NH
3↑+2H
2O+CaCl
2;
②根据制取气体的原则和方法,故制取并收集氨气应选用上图中A、D组合;
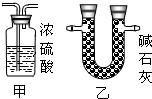
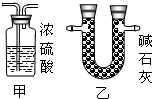
③为确保实验结果的准确性,他认为还应该在A、B之间增加一个干燥装置.干燥气体而不能与之反应,故选碱石灰(NaOH和CaO固体混合物),而不应选择浓硫酸;因为浓硫酸会与氨气反应;
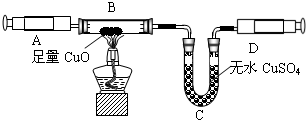
④由题意,可知反应物为氨气和氧化铜,生产物为水、铜、氮气,故化学方程式为2NH
3+3Cu0

3H
2O+3Cu+N
2;
⑤由题意,可知反应物为氧化亚铜与稀硫酸,生产物为CuS0
4和Cu和水,故可书写化学方程式Cu
20+H
2SO
4=CuS0
4+Cu+H
2O;红色物质中是否含有Cu
20:考虑生产物中的水会与硫酸铜反应形成蓝色溶液,或白色硫酸铜粉末变蓝;
⑥解:氢氧化铜的物质的量为9.8÷98=0.1摩尔,则知铜元素的物质的量为0.1摩尔,又知红色粉末A的质量为7.2g,推测其化学式的相对分子质量只能为144的氧化亚铜.
故答为:(1)分液漏斗;锥形瓶;
(2)不漏气;
(3)一小团棉花;2KMnO
4
K
2MnO
4+MnO
2+O
2↑;先移导管后熄灯;
(4)①2NH
4Cl+Ca(OH)
2
2NH
3↑+2H
2O+CaCl
2;②A、D;③乙;④2NH
3+3Cu0

3H
2O+3Cu+N
2;
⑤Cu
20+H
2SO
4=CuS0
4+Cu+H
2O;向该红色物质中加入一定量的稀硫酸,观察是否有蓝色溶液或蓝色晶体生成.
⑥Cu
20;Cu
20
分析:(1)了解常用仪器的名称、用法、装置选取和连接方法;
(2)掌握检查装置气密性的方法:通过气体发生器与附设的液体构成封闭体系,依据改变体系内压强时产生的现象(如气泡的生成,水柱的形成,液面的升降等)来判断装置气密性的好坏;
(3)如果实验室用A、E组合来制取并收集氧气,如果加一小团棉花,则一定为高锰酸钾加热制取氧气;注意制取氧气的步骤:“查、装、定、点、收、离(移)、熄”谐音“茶庄定点收利息”,步骤不能颠倒.
(4)①由题意,可知反应物为:氯化铵固体和氢氧化钙,符合复分解反应特征,故可书写化学方程式;
②制取气体,选择装置,考虑反应物的状态和反应条件;收集气体的装置,考虑其密度和水溶性;
③因为氧化铜与氨气反应,会有水生成,故为了排除干扰,先把氨气中的水蒸气除掉;
④由题意,可知反应物为氨气和氧化铜,生产物为水、铜、氮气,故可书写化学方程式;
⑤由题意,可知反应物为氧化亚铜与稀硫酸,生产物为CuS0
4和Cu和水,故可书写化学方程式;设计一个简单的实验检验该红色物质中是否含有Cu
20:考虑生产物中的水会与硫酸铜反应形成蓝色溶液,或白色硫酸铜粉末变蓝.
⑥根据氢氧化铜的质量,求其物质的量;由红色粉末A的质量为7.2g,推测其化学式的相对分子质量,推测其化学式.
点评:掌握气体制取装置的探究方法;了解实验探究物质的性质、变化规律、组成成分及含量的方法;了解检查装置的气密性的方法;了解化学式的计算和推断方法;掌握化学方程式的方法、步骤.


 K2MnO4+MnO2+O2↑;先移导管后熄灯,防止水倒流,引起试管炸裂.
K2MnO4+MnO2+O2↑;先移导管后熄灯,防止水倒流,引起试管炸裂. 2NH3↑+2H2O+CaCl2;
2NH3↑+2H2O+CaCl2; 3H2O+3Cu+N2;
3H2O+3Cu+N2; K2MnO4+MnO2+O2↑;先移导管后熄灯;
K2MnO4+MnO2+O2↑;先移导管后熄灯; 2NH3↑+2H2O+CaCl2;②A、D;③乙;④2NH3+3Cu0
2NH3↑+2H2O+CaCl2;②A、D;③乙;④2NH3+3Cu0 3H2O+3Cu+N2;
3H2O+3Cu+N2;

 阅读快车系列答案
阅读快车系列答案