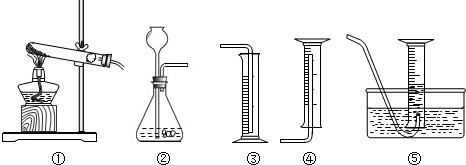
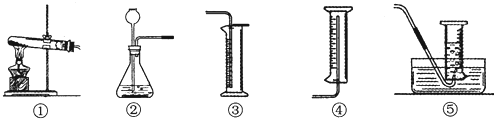
解答:解:(1)反应物是过氧化氢写在等号的左边,生成物是水和氧气写在等号的右边,用观察法配平,所以方程式是:2H
2O
22H
2O+O
2↑,由于在反应中过氧化氢属于反应物,在不断的消耗,所以质量在不断减少;生成物是水和氧气,所以溶液中的溶剂水在不断增加;
(2)从题干中提供的信息可知,所用过氧化氢溶液的量和质量分数都是相同的,只是三次加入的二氧化锰的量不同,并且记录了在不同量二氧化锰的条件下,不同时间生成的氧气的量.可见此实验探究达到问题是:二氧化锰的质量对过氧化氢分解快慢的影响.
(3)实验中要称取二氧化锰,所以要用到天平;并要计时,所以用秒表.
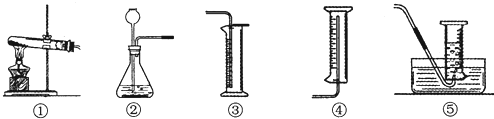
(4)过氧化氢溶液和二氧化锰反应是固体和液体的不加热反应,可用装置②完成;氧气密度大于空气密度,并且不易溶于水,所以可用向上排空气法和排水法收集,要记录一定时间内收集到的气体体积,所以用②⑤合适.
(5)在40秒时,通过观察在该时间内生成氧气的体积数值比较可知,MnO
2的质量愈多,H
2O
2分解速率愈大;
(6)催化剂反应前后质量不变,所以实验后经过滤、洗涤、干燥、称量,MnO
2质量仍然为0.1g;从过氧化氢分解后的混合物中回收二氧化锰,再将其放在氯酸钾中加热,利用带火星的木条检验生成氧气的快慢.所以取少量相同质量的氯酸钾于试管中,并向其中的一支试管中加入上述MnO
2拌和.同时加热两支试管并在试管的上方各放带火星(燃着)的木棒,若盛放MnO
2的试管上方的木棒先复燃(燃烧的更旺),则可证明MnO
2的化学性质不变.
故答案为:(1)2H
2O
22H
2O+O
2↑; H
2O
2;增多;(2)二氧化锰的质量对过氧化氢分解快慢的影响;(3)天平、停表(或秒表);(4)②⑤;反应物的状态(固体和液体)且不加热;(5)在该时间内,MnO
2的质量愈多,H
2O
2分解速率愈大(MnO
2催化效果愈好)(6)0.1;取少量相同质量的氯酸钾于试管中,并向其中的一支试管中加入上述MnO
2拌和.同时加热两支试管并在试管的上方各放带火星(燃着)的木棒,若盛放MnO
2的试管上方的木棒先复燃(燃烧的更旺),则可证明MnO
2的化学性质不变.



 名校课堂系列答案
名校课堂系列答案