3克不纯锌(含金属M)和3克不纯的铁(含金属N)分别与足量的稀硫酸充分反应后,都得到0.1克氢气,则M、N可能是( )
A.M为Fe,N为Mg
B.M为Al,N为Ag
C.M为Mg,N为Zn
D.M为Cu,N为Al
【答案】
分析:根据金属与酸反应的化学方程式,采用极值法计算出产生氢气的质量,再进行分析比较.
解答:解:设3g纯锌与足量稀硫酸充分反应放出H
2的质量为x
Zn+H
2SO
4=ZnSO
4+H
2↑
65 2
3g x
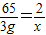
解之得x≈0.09g<实际产生的氢气质量0.1g
则3g不纯的锌中所含的杂质M也能与稀硫酸反应生成H
2,且3g纯M反应生成H
2的质量大于0.1g,故M的相对原子质量比Zn的相对原子质量(65)小.
同理分析,N的相对原子质量应比Fe的相对原子质量(56)大,或者N不能与稀硫酸反应置换出H
2.符合条件的有BC两项.
故选BC.
点评:化合价相同的两种活泼金属与足量酸溶液反应生成氢气的质量与其相对原子质量成正比.



 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案