
物质的鉴别、分离和提纯是重要的基本实验操作。
(1)鉴別氢氧化纳和碳酸钠两种溶液,不可选择________ (填字母)。
A.氯化钡溶液 B.硝酸钠溶液 C.稀硫酸
(2)除去硝酸钾溶液中混有的少量硫酸钾,可加入适量的硝酸钡溶液,充分反应后过滤即可。写出反应的化学方程式__________________________。
 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案科目:初中化学 来源:2017年初中毕业升学考试(天津卷)化学(解析版) 题型:选择填充题
我国的稀土储量居世界第一位。铕(Eu)是一种稀土元素,下列有关说法中错误的是( )

A. 铕属于非金属元素 B. 铕的原子序数是63
C. 铕原子中的质子数为63 D. 铕的相对原子质量是152.0
查看答案和解析>>
科目:初中化学 来源:2017年初中毕业升学考试(四川雅安卷)化学(解析版) 题型:选择题
高氯酸钾( KClO4 ) 可用作火箭推进剂, 其溶解度如下表。下列说法不正确的是
温度 /℃ | 20 | 40 | 60 | 80 |
溶解度 /g | 1.68 | 3.73 | 7.3 | 13.4 |
A.高氯酸钾的溶解度随温度降低而减小
B.20℃时, 将 2g 高氯酸钾溶于 98g 水中, 所得溶液中溶质的质量分数小于 2%
C.60℃时, 高氯酸钾饱和溶液中溶质的质量分数小于 7.3%
D.80℃的高氯酸钾溶液冷却至 40℃肯定有晶体析出
查看答案和解析>>
科目:初中化学 来源:2017年初中毕业升学考试(四川遂宁卷)化学(解析版) 题型:选择题
向装有过量锌粉的烧杯中加入一定质量AgNO3和Cu(NO3)2的混合溶液,烧杯中固体的质量随反应时间变化的情况如图所示。下列说法正确的是
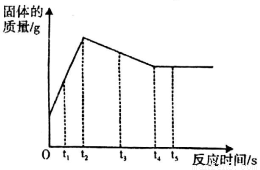
A.t1时,向溶液中滴加氯化钠溶液,没有白色沉淀产生
B.t3和t5时,溶质种类不同,金属单质种类也不同
C.若向溶液中插入铝丝,铝丝表面有红色固体析出,则时间t的取值范围是:t2<t<t4
D.t2时,溶液中的金属离子有Zn2+、Cu2+,固体中的金属单质有Zn、Ag
查看答案和解析>>
科目:初中化学 来源:2017年初中毕业升学考试(四川内江卷)化学(解析版) 题型:计算题
根据下图所示信息进行计算。假设:稀硫酸转移完全且生成气体全部逸出。
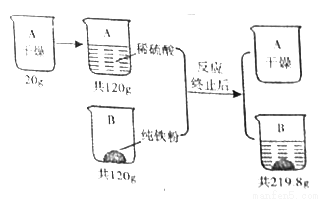
(1)生成H2的质量为_____________g。
(2)反应后的溶液中溶质质量分数为多少?(写出解题过程,最后结果保留两位小数)
查看答案和解析>>
科目:初中化学 来源:2017年初中毕业升学考试(四川内江卷)化学(解析版) 题型:选择题
将一定量的氢氧化钠溶液与稀盐酸混合,二者恰好充全反应的微观示意图如下。由此分析下列说法正确的是
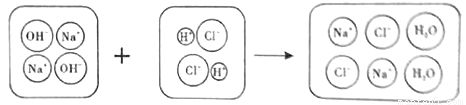
A.反应前后阴、阳离子的总数目不变 B.反应前后溶剂质量不变
C.反应后溶液呈中性 D.反应前后元素种类发生了变化
查看答案和解析>>
科目:初中化学 来源:2017年初中毕业升学考试(四川内江卷)化学(解析版) 题型:选择题
“染色”馒头中添加有铬酸铅(PbCrO4),颜色为柠檬黄,会使人体致癌,已被卫生部明文禁用。已知铬元素(Cr)化合价为+6价,则铅元素的化合价为
A.+2 B.+4 C.+5 D.+7
查看答案和解析>>
科目:初中化学 来源:2017年初中毕业升学考试(浙江湖州卷)化学(解析版) 题型:探究题
科学兴趣小组在探究酸的性质时,做了如下实验:向放有少量CuO粉末的试管中加入6毫升盐酸,观察到黑色粉末很快溶解,并得到蓝绿色溶液.而向放有少量CuO粉末的试管中加入6毫升硫酸溶液,常温下无明显现象。为什么会产生这种差异呢?
【建立猜想】①两种酸溶液的pH不同.(注:pH相同,则单位体积溶液中H+数目相同)
②两种酸溶液中的________不同。
【实验过程】
实验 次数 | 试剂 | 实验 条件 | 实验现象 |
1 | 0.2克CuO粉末+6毫升pH=0的盐酸 | 常温 | 黑色粉末很快溶解,溶液呈蓝绿色 |
2 | 0.2克CuO粉末+6毫升pH=0的硫酸 | 常温 | 无明显现象 |
3 | 0.2克CuO粉末+6毫升pH=0的硫酸+0.35克NaCl | 常温 | 黑色粉末很快溶解,溶液呈蓝绿色 |
4 | 0.2克CuO粉末+6毫升pH=0的硫酸+0.35克______ | 常温 | 无明显现象 |
【实验结论】常温下,pH相同的盐酸和硫酸溶液与CuO反应现象出现差异的原因是由于______促进了反应的进行。
查看答案和解析>>
科目:初中化学 来源:2017年初中毕业升学考试(新疆建设兵团卷)化学(解析版) 题型:填空题
废旧金属可回收利用,用合金废料(含Fe、Cu和Al)制取FeSO4溶液和回收金属Cu。实验流程如下图所示(部分生成物已略):
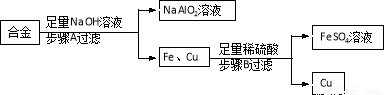
(1)合金属于____________(填“纯净物”或“混合物”)。
(2)生活中铝比铁更耐腐蚀的原因____________(用化学反应方程式解释)。
(3)步骤A化学反应方程式表示为:2A1+2NaOH+2R=2NaA1O2+3H2↑,依据质量守恒定律推出R的化学式为_____________________。
(4)步骤B发生的化学反应方程式为__________________________;反应的基本类型为___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com