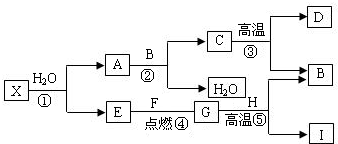
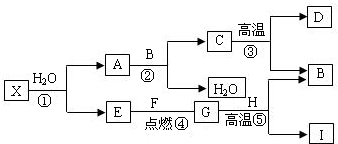
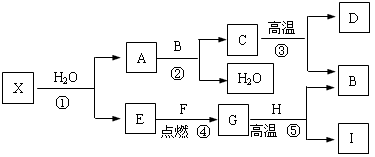
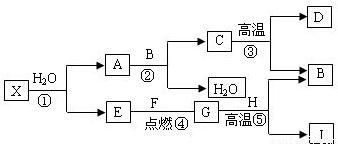
解:I为目前使用最广泛的金属,则I为铁;B能使澄清的石灰水变浑浊,则B为二氧化碳;⑤是工业中冶炼目前使用最广泛的一种金属I 的反应,G为气体,生成物中还有二氧化碳,则G为一氧化碳;H为氧化铁;E和F点燃生成G一氧化碳,E为气体单质,则E为氧气;F为碳;C高温生成B二氧化碳和D,则C为碳酸钙;D为氧化钙;A和B二氧化碳反应生成C碳酸钙和水,则A为氢氧化钙.
(1)根据上述分析可知⑤发生的反应为一氧化碳和氧化铁高温生成铁和二氧化碳.
故答案为:3CO+Fe
2O
3
2Fe+3CO
2(2)根据上述分析可知C为碳酸钙,碳酸钙高温生成氧化钙和二氧化碳,向反应后的固体中加入稀盐酸,若有气泡冒出,则说明碳酸钙未分解完;取少量反应后的固体,加少量水,滴入无色的酚酞溶液,若溶液变成红色,说明反应后的固体中有氧化钙生成,碳酸钙发生分解.从而说明碳酸钙部分发生了分解.
故答案为:加入稀盐酸,如果产生气泡,说明碳酸钙有剩余;加入少量的水,搅拌,滴入几滴酚酞试液,如果变红色,说明已有氧化钙生成,碳酸钙发生了分解.
(3)根据上述分析可知A为氢氧化钙,E为氧气,根据质量守恒定律,化学反应前后元素的种类不变可知,X中一定含有钙元素,可能含有氢元素和氧元素,又知X为氧化物,则X中含有钙元素和氧元素.
X中钙元素和氧元素的原子数目比=
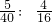
=1:2,则X为化学式为:CaO
2.
故答案为:CaO
2分析:I为目前使用最广泛的金属,可确定I的成份;B能使澄清的石灰水变浑浊,可确定B的成份;根据⑤是工业中冶炼目前使用最广泛的一种金属I 的反应,G为气体,可确定G的成份;进而确定H的成份;E和F点燃生成G,E为单质,可确定E、F的成份;C高温生成B和D,可确定C、D的成份;根据A和B反应生成C和水又可确定A的成份.
(1)根据上述分析可知道⑤发生的反应,熟记一些常用的化学方程式.
(2)C物质为碳酸钙,要证明碳酸钙部分分解,也就是要证明反应后的固体中即有未分解的碳酸钙,又有分解生成的氧化钙.可根据检验碳酸根离子的方法来检验是否有碳酸钙,可根据加水溶解后的溶液是否显碱性来确定是否有氧化钙.
(3)根据元素质量比比上相对原子质量比为原子数目之比求出这两种元素的角码之比,然后根据化学式的写法特点写出该物质的化学式.
点评:本题综合考查物质推断题的解题能力.解题关键是挖掘“题眼”,熟悉所学的基本化学反应,并能根据题干信息很快联想相应的特征反应.

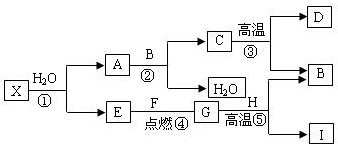
 2Fe+3CO2
2Fe+3CO2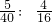 =1:2,则X为化学式为:CaO2.
=1:2,则X为化学式为:CaO2.